题目内容
2.某同学称取11.8g碳酸钠样品(混有氯化钾)放于烧杯中,然后向其中加入了过量的16%的氯化钙溶液,充分反应后将生成的沉淀过滤,洗涤,干燥,称其质量为1.00g.计算样品中碳酸钠的质量分数.分析 样品中只有碳酸钠和氯化钙溶液反应生成碳酸钙沉淀,所以根据化学方程式计算出碳酸钠的质量,进而计算出碳酸钠的质量分数.
解答 解:设产生1.00g碳酸钙沉淀需要碳酸钠的质量为x.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 1.00g
根据:$\frac{106}{100}=\frac{x}{1.00g}$,解得:x=1.06g,
所以样品中Na2CO3质量分数为:$\frac{1.06g}{11.8g}$×100%≈9%
答:纯碱样品中碳酸钠的质量分数约为9%;
点评 根据化学方程式能表示反应中各物质的质量比,由反应中某种物质的质量可计算出反应中其它物质的质量.

练习册系列答案
相关题目
13.如图所示实验操作不正确的是( )
| A. |  蒸发 | B. |  取用固体粉末 | C. |  取用液体 | D. |  铁丝在O2中燃烧 |
14.下列对实验现象的描述中,正确的是( )
| A. | 红磷燃烧时,会产生大量的白雾 | |
| B. | 铁丝在氧气中剧烈燃烧,生成黑色固体 | |
| C. | 木炭在氧气中燃烧时生成黑色固体 | |
| D. | 硫在氧气中燃烧时,会发出淡蓝色火焰 |
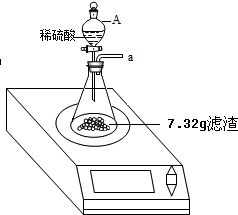 某化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
某化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末. 生活中物质之间常常可以相互转化,如图.
生活中物质之间常常可以相互转化,如图.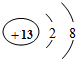 和
和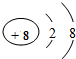 形成的化合物Al2O3.
形成的化合物Al2O3. “减少污染、净化空气,还我一片蓝天”,已成为人们共同的心声.
“减少污染、净化空气,还我一片蓝天”,已成为人们共同的心声. ,因为加气站空气中含有天然气,遇到明火,可能会爆炸.
,因为加气站空气中含有天然气,遇到明火,可能会爆炸.