题目内容
菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中镁元素的含量,某学习小组进行了实验研究,取10g菱镁矿,逐渐加入未知浓度的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如下表:
| 加入H2SO4溶液的质量/g | 50 | 100 | 150 | 200 |
| NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
说明:菱镁矿中的杂质不溶于水,不与酸发生反应。
(1)10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为 。
(2)计算该菱镁矿中镁元素的质量分数。(写出计算过程)
(3)该实验研究中所用H2SO4溶液的溶质的质量分数是 。
(4)为避免溶液排放对环境影响,某同学对上述反应后溶液进行了过滤,并在滤液中加入了1.71%的Ba(OH)2溶液。请你画出加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标中作图,并标出曲线折点的坐标)
【答案】(1)4.4g
(2)解:设10g菱镁矿中碳酸镁的质量为x,实验中所硫酸的质量为y,生成硫酸镁的质量为z。
MgCO3+H2SO4=MgSO4+CO2↑+H2O
84 98 120  44
44
x y z 4.4g
 =
= 
x=  =8.4g
=8.4g
 y=
y= =9.8g
=9.8g
 =
=  z=
z=  =12g
=12g
菱镁矿中镁元素的质量分数=  ×100%=24%
×100%=24%
(3)该实验研究中所用H2SO4溶液的溶质质量分数是 =9.8%
=9.8%
(4)
【解析】根据表格信息不难发现,10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为4.4g;要计算菱镁矿中镁的质量分数,需先根据碳酸镁与硫酸反应的化学方程式及二氧化碳的质量,计算出碳酸镁的质量,然后再结合碳酸镁中镁元素的质量分数计算出镁元素的质量最后表示出,碳酸镁中镁元素的质量分数即可;碳酸镁与硫酸反应的化学方程式及生成二氧化碳的质量,可计算出参加反应的硫酸的质量,再结合硫酸溶液的质量便可计算出所使用硫酸的溶质质量分数;实验中加入的硫酸的总质量为200g×9.8%=19.6g,与氢氧化钡反应的硫酸质量19.6g-9.8g=9.8g,根据H2SO4+Ba(OH)2=BaSO4↓+2H2O可计算出参加反应的氢氧钡溶液的质量为1000g,生成硫酸钡沉淀的质量为13.7g,根据参加反应的硫酸镁的质量及MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓可计算出参加反应的氢氧钡溶液的质量为1000g,反应生成硫酸钡沉淀的质量为13.7g,反应生成氢氧化镁沉淀的质量为5.8g。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案某奶制品的营养成分见表。
某奶制品的营养成分表
| 项 目 | 每100 mL | NRV% |
| 能量 | 290 kJ | 3% |
| 蛋白质 | 3.2 g | 5% |
| 脂肪 | 4.0 g | 7% |
| 碳水化合物 | 4.8 g | 2% |
| 钠盐 | 62 mg | 3% |
(1)________和水也是人体必需的基本营养物质,但在表中未标示。
(2)该奶制品中________能够提供能量(任写一种)。
(3)奶制品中含有丰富的钙________(选填“单质”“原子”或“元素”),儿童每日要摄取足够量的钙,才能避免________(填字母序号)。
a.贫血症 b.佝偻病 c.甲状腺肿大
(4)下列物质不会使蛋白质失去原有生理活性的是________(填字母序号)。
a.浓硝酸 b.乙酸铅 c.硫酸铵 d.甲醛
 质
质 216.2g(假设贝壳中其他物质不与盐酸反应且不溶于水)。请你计算:
216.2g(假设贝壳中其他物质不与盐酸反应且不溶于水)。请你计算: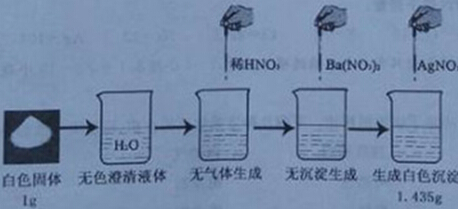

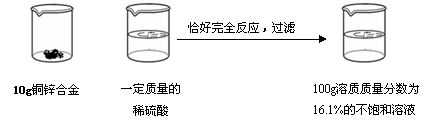
 .1%)
.1%)