题目内容
将氯化钠和碳酸钠的混合物33.8g放入125g稀盐酸中,恰恰好完全反应,得氯化钠溶液150g。计算:
(1)反应后生成的CO2质量是 。
(2)反应后所得溶液中溶质质量分数为多少?(要求有计算过程)
【答案】(1)8.8g
(2)设原固体混合物中碳酸钠的质量为x,生成氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 8.8g
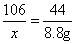
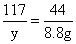
x=21.2g y=23..4g
所得溶液中溶质的质量=23.4g+(33.8g -21.2g)=36g
所得溶液中溶质的质量分数=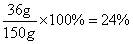
【解析】
(1)根据质量守恒定律,化学反应前后物质的总质量不变,向碳酸钠和氯化钠的固体混合物中加入稀盐酸,只是碳酸钠与盐酸反应,反应后生成了二氧化碳气体不存在于溶液中,可以求得二氧化碳的质量;
(2)要求溶液中溶质的质量分数,需要知道溶质的质量,而溶质有两部分,一部分是原有的氯化钠,一部分是生成的氯化钠。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中镁元素的含量,某学习小组进行了实验研究,取10g菱镁矿,逐渐加入未知浓度的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如下表:
| 加入H2SO4溶液的质量/g | 50 | 100 | 150 | 200 |
| NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
说明:菱镁矿中的杂质不溶于水,不与酸发生反应。
(1)10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为 。
(2)计算该菱镁矿中镁元素的质量分数。(写出计算过程)
(3)该实验研究中所用H2SO4溶液的溶质的质量分数是 。
(4)为避免溶液排放对环境影响,某同学对上述反应后溶液进行了过滤,并在滤液中加入了1.71%的Ba(OH)2溶液。请你画出加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标中作图,并标出曲线折点的坐标)
 CuSO4+ xH2O↑
CuSO4+ xH2O↑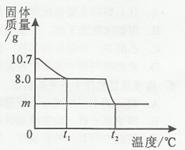

 mg;
mg;
 的______溶
的______溶 液(填“饱和”或“不饱和”)。
液(填“饱和”或“不饱和”)。