题目内容
请根据下图所示的实验过程和提供的数据计算
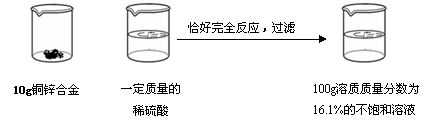 |
+
(1)生成氢气 g;
(2)合金中铜的质量分数是 ;
(3)所用稀硫酸的溶质质量分数是多少?(写出计算过程,计算结果保留到0 .1%)
.1%)
【答案】解:(1)0.2g
(2)35%
(3)生成ZnSO4的质量为100g×16.1%=16.1g
设稀硫酸中硫酸的质量为x,生成氢气的质量为y
Zn+H2SO4=ZnSO4+H2↑
98 161 2
x 16.1g y

 x=9.8g y=0.2g
x=9.8g y=0.2g
所用稀硫酸的溶质质量分数为 ×100% ≈10.5%

或 ×100% ≈10.5%
答:所用稀硫酸的溶质质量分数为10.5%
【解析】100g溶质质量分数为16.1%的溶液,是硫酸锌的溶液,其溶质的质量为100g×16.1%=16.1g,将此数据代入化学 方程式,即可得到结果。
方程式,即可得到结果。

某同学在实验室发现一瓶由碳酸钠和氯化钠组成的混合溶液.为了测定该混合溶液中碳酸钠的质量分数,该同学设计了如下实验:取该混合溶液50g,向其中逐滴加入稀盐酸,当加入盐酸的质量为15g、30g、45g、60g时,生成气体的质量见下表(气体的溶解度忽略不计).
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 | |
| 稀盐酸的质量/g | 15 | 30 | 45 | 60 |
| 生成气体的质量/g | 1.8 | n | 4.4 | 4.4 |
(1)第Ⅱ组数据n为 _________ g.
(2)混合溶液中碳酸钠的质量分数是多少?(写出计算过程,结果精确至0.1%)
菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中镁元素的含量,某学习小组进行了实验研究,取10g菱镁矿,逐渐加入未知浓度的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如下表:
| 加入H2SO4溶液的质量/g | 50 | 100 | 150 | 200 |
| NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
说明:菱镁矿中的杂质不溶于水,不与酸发生反应。
(1)10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为 。
(2)计算该菱镁矿中镁元素的质量分数。(写出计算过程)
(3)该实验研究中所用H2SO4溶液的溶质的质量分数是 。
(4)为避免溶液排放对环境影响,某同学对上述反应后溶液进行了过滤,并在滤液中加入了1.71%的Ba(OH)2溶液。请你画出加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标中作图,并标出曲线折点的坐标)

 mg;
mg;

 A.氯原子的中子数是17
A.氯原子的中子数是17