题目内容
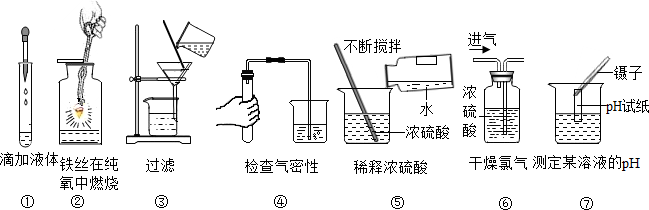
16.除去下列各物质中的少量杂质,所选用的试剂、方法均正确的是( )| 编号 | 物质 | 杂质(少量) | 试剂 | 除杂操作方法 |
| A | Fe | Cu | 足量稀盐酸 | 过滤、烘干 |
| B | NaOH | Na2CO3 | 适量的稀盐酸 | 蒸发 |
| C | CO2 | CO | -- | 点燃 |
| D | NaCl | NaOH | 足量稀盐酸 | 蒸发 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、Fe能与足量稀盐酸反应生成氯化亚铁溶液和氢气,铜不与稀盐酸反应,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
B、CO2和Na2CO3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
C、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;故选项所采取的方法错误.
D、NaOH能与足量稀盐酸反应生成氯化钠和水,再蒸发,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
故选:D.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
7.用一种试剂(括号内物质)不能将组内的三种物质鉴别开来的是( )
| A. | CO2、O2、N2,三种无色气体(燃着的木条) | |
| B. | 稀H2SO4、Ca(OH)2、NaCl,三种无色溶液(石蕊溶液) | |
| C. | NaOH、Na2CO3、CaCO3,三种白色固体(水) | |
| D. | CuO、C、Fe,三种黑色粉末(稀硫酸) |
11.下列实验操作中正确的是( )
| A. |  称量氢氧化钠 称量氢氧化钠 | B. |  闻气味 | C. |  溶解氯化钠固体 | D. |  浓硫酸稀释 |
2.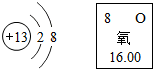 元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
(1)根据如图信息,写出甲、乙两种元素的单质间发生反应的化学方程式:4Al+3O2=2Al2O3.
(2)某同学将铁片放入CuSO4溶液中,发现铁片表面有红色物质析出,同时还有少量无色无味气泡产生.对于产生气泡的“异常现象”,下列猜想不合理的是B(填字母).
A、产生的气体可能是H2 B、产生的气体可能是CO2
C、CuSO4溶液中可能含有少量的某种酸 D、CuSO4溶液的pH可能小于7
(3)某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”,某研究性学习小组对该厂生产的烧碱样品进行如下探究.
【提出问题】烧碱样品中含有哪些杂质?
【猜想】
猜想一:可能含有Na2CO3,作出此猜想的依据是:CO2+2NaOH=Na2CO3+H2O(用化学方程式表示).
猜想二:可能含有NaCl,作出此猜想的依据是:可能有少量的氯化钠没有反应(用简洁的文字表述).
【设计实验】
(4)某同学取100g含有H2SO4的酸性废水,然后滴加烧碱溶液中和,至溶液pH=7时,共消耗质量分数为20%的烧碱溶液20g.求这种废水中含H2SO4的质量分数.
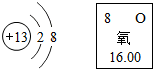 元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.(1)根据如图信息,写出甲、乙两种元素的单质间发生反应的化学方程式:4Al+3O2=2Al2O3.
(2)某同学将铁片放入CuSO4溶液中,发现铁片表面有红色物质析出,同时还有少量无色无味气泡产生.对于产生气泡的“异常现象”,下列猜想不合理的是B(填字母).
A、产生的气体可能是H2 B、产生的气体可能是CO2
C、CuSO4溶液中可能含有少量的某种酸 D、CuSO4溶液的pH可能小于7
(3)某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”,某研究性学习小组对该厂生产的烧碱样品进行如下探究.
【提出问题】烧碱样品中含有哪些杂质?
【猜想】
猜想一:可能含有Na2CO3,作出此猜想的依据是:CO2+2NaOH=Na2CO3+H2O(用化学方程式表示).
猜想二:可能含有NaCl,作出此猜想的依据是:可能有少量的氯化钠没有反应(用简洁的文字表述).
【设计实验】
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁 | 试管外壁发热 | 原因是氢氧化钠固体溶于水放热 |
| ②向①所得的溶液中逐渐加入稀硝酸至过量 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体 | 样品中含有的杂质是碳酸钠 |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂质是氯化钠 |
3.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下充分反应,测得反应前后各物质质量如表:
下列推断不正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量(g) | 8 | 1 | 36 | 10 |
| 反应后质量(g) | 待测 | 20 | 0 | 31 |
| A. | 甲待测的质量值为4 | B. | 该反应的类型不可能是分解反应 | ||
| C. | 该反应的类型可能是化合反应 | D. | 该反应遵守质量守恒定律 |