题目内容
1.某化学兴趣小组的同学为了探究金属的性质,做了如下探究实验.实验1:在三支分别装有硫酸镁溶液、硫酸铜溶液和稀硫酸的试管中,各加入少量铝条(如图).
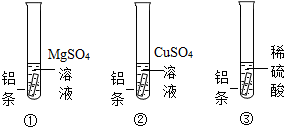
【实验现象】①、②试管内始终无明显现象,而试管③中开始时无明显现象,但片刻后出现大量的气泡.
【分析反思】试管②中始终无明显现象的原因是铝条表面有一层氧化物,试管③中开始无气体产生的原因是Al2O3+3H2SO4═Al2(SO4)3+3H2O(用化学方程式表示).
实验2:将实验1反应后的三支试管中的剩余物全部倒入一个干净的烧杯中,片刻后发现有气泡冒出,并有紫红色固体析出.
【现象分析】析出紫红色固体的原因是2Al+3CuSO4═Al2(SO4)3+3Cu(用化学方程式表示).
【得出结论】该探究实验说明铝的金属活动性比铜更强.
同学们想确定实验2反应结束后烧杯中所得固体的成分.
【提出猜想】小明的猜想是:含有铝和铜;小莉的猜想是:含有铝和镁.小花认为小莉的猜想不成立,理由是铝不能和硫酸镁反应.
实验3:同学们经检验烧杯中所得的固体,证明小明的猜想正确.请完成下表:
| 实验步骤 | 实验现象 | 结论 |
| 向滤出的固体中加入稀硫酸 | 固体部分溶解有红色固体剩余,产生气泡 | 固体中含有铜和铝. |
分析 实验1:通常情况下,铝能够被空气中的氧气氧化;
氧化铝和稀硫酸反应生成硫酸铝和水;
实验2:铝和稀硫酸反应生成硫酸铝和氢气,和硫酸铜反应生成硫酸铝和铜;
镁比铝活泼,因此铝不能和硫酸镁反应;
铜不能和稀盐酸反应.
解答 解:实验1:试管②中始终无明显现象的原因是铝条表面有一层氧化物.
故填:铝条表面有一层氧化物.
试管③中开始时无明显现象的原因是氧化铝和稀硫酸反应生成了硫酸铝和水,反应的化学方程式为:Al2O3+3H2SO4═Al2(SO4)3+3H2O.
故填:Al2O3+3H2SO4═Al2(SO4)3+3H2O.
实验2:析出紫紅色固体的原因是铝和硫酸铜反应生成了硫酸铝和铜,反应的化学方程式为:2Al+3CuSO4═Al2(SO4)3+3Cu.
故填:2Al+3CuSO4═Al2(SO4)3+3Cu.
【得出结论】该探究实验说明铝的金属活动性比铜更强.
故填:强.
【提出猜想】小明的猜想是:含有铝和铜;小莉的猜想:含有铝和镁.小花认为小莉的猜想不成立,理由是铝不能和硫酸镁反应.
故填:铝不能和硫酸镁反应.(或铝没有镁活泼,不能将镁从它的盐溶液中置换出来)
实验3:同学们经检验烧杯中所得的固体,证明小明的猜想正确如下表所示:
| 实验步骤 | 实验现象 | 结论 |
| 向滤出的固体中加入足量稀盐酸 | 固体部分溶解有红色固体剩余,产生气泡 | 残余固体中含有铜和铝 |
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
11. 在实验室里,利用下列物质和装置制取气体的方法正确的是( )
在实验室里,利用下列物质和装置制取气体的方法正确的是( )
 在实验室里,利用下列物质和装置制取气体的方法正确的是( )
在实验室里,利用下列物质和装置制取气体的方法正确的是( )| A. | 二氧化锰和氯酸钾制取氧气 | B. | 大理石和稀盐酸制取二氧化碳 | ||
| C. | 大理石与稀硫酸制取二氧化碳 | D. | 锌和稀硫酸制取氢气 |
9.下列同学们的讨论中,不正确的是( )
| A. | 水不是人体所需的营养素 | B. | 鸡蛋含有较丰富的蛋白质 | ||
| C. | 甲烷是最简单的有机物 | D. | 碘摄入过量也会引起大脖子病 |
16.除去下列各物质中的少量杂质,所选用的试剂、方法均正确的是( )
| 编号 | 物质 | 杂质(少量) | 试剂 | 除杂操作方法 |
| A | Fe | Cu | 足量稀盐酸 | 过滤、烘干 |
| B | NaOH | Na2CO3 | 适量的稀盐酸 | 蒸发 |
| C | CO2 | CO | -- | 点燃 |
| D | NaCl | NaOH | 足量稀盐酸 | 蒸发 |
| A. | A | B. | B | C. | C | D. | D |
3.实验室有两瓶常温下的饱和溶液,已知它们是氢氧化钠溶液和石灰水,为了区分并验证它们的性质,张林和李莉同学进行了如下探究实验.
(一)张林同学用物理方法鉴别它们.他从两瓶溶液取出来少许装入试管并在酒精灯上加热.他根据溶液变浑浊现象,判断甲瓶为石灰水.
(二)李莉同学用化学方法鉴别它们.她从两瓶溶液取出来少许装入试管并向里面吹气,也判断出甲瓶为石灰水,看到现象的化学反应方程式为Ca(OH)2+CO2═CaCO3↓+H2O.
(三)乙瓶溶液敞放在空气中可能变质.为了探究乙瓶是否变质?以及变质后溶液中溶质的成分?两位同学做了如下猜测和实验.
【提出猜想】:①只有NaOH ②只有Na2CO3 ③Na2CO3和NaOH ④…
【查阅资料】:已知NaCl、CaCl2溶液呈中性,Na2CO3溶液能使酚酞变红.
【实验与结论】:
(1)取少许溶液并加入盐酸,看不到任何现象就可证明猜想①成立.
(2)若氢氧化钠溶液已经变质,要探究氢氧化钠溶液是否完全变质,他们做了如下实验.
【反思与交流】:步骤1中所加溶液需过量的主要原因是使碳酸钠完全反应.
(一)张林同学用物理方法鉴别它们.他从两瓶溶液取出来少许装入试管并在酒精灯上加热.他根据溶液变浑浊现象,判断甲瓶为石灰水.
(二)李莉同学用化学方法鉴别它们.她从两瓶溶液取出来少许装入试管并向里面吹气,也判断出甲瓶为石灰水,看到现象的化学反应方程式为Ca(OH)2+CO2═CaCO3↓+H2O.
(三)乙瓶溶液敞放在空气中可能变质.为了探究乙瓶是否变质?以及变质后溶液中溶质的成分?两位同学做了如下猜测和实验.
【提出猜想】:①只有NaOH ②只有Na2CO3 ③Na2CO3和NaOH ④…
【查阅资料】:已知NaCl、CaCl2溶液呈中性,Na2CO3溶液能使酚酞变红.
【实验与结论】:
(1)取少许溶液并加入盐酸,看不到任何现象就可证明猜想①成立.
(2)若氢氧化钠溶液已经变质,要探究氢氧化钠溶液是否完全变质,他们做了如下实验.
| 实验步骤 | 实验现象 | 实验结论或方程式 |
| 步骤1:取少量已变质的NaOH溶液于试管中,加入过量的氯化钙溶液 | 白色浑浊 | 反应方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |
| 步骤2:取步骤1所得的澄清溶液少许,并向清液滴入几滴酚酞. | 酚酞试液不变色 | 猜想②成立 |
酚酞试液变红色 | 猜想③成立 |
8.设计实验方案是科学探究的重要环节,以下化学实验设计中,不能达到实脸目的是( )
| A. | 厨房中用食醋鉴别纯碱和食盐 | |
| B. | 用稀硫酸除去铁粉中混有的少量铜粉 | |
| C. | 用AgNO3溶液检验H2中混入的少量HCl杂质 | |
| D. | 用稀盐酸检验暴露在空气中的NaOH固体是否变质 |