题目内容
11.化学与食品、药品安全近年来,食品安全已受到了国人的普遍关注.但是一些不法商贩仍然不顾国家法律,置若罔闻,从瘦肉精到染色馒头、毒豆芽、地沟油、药品胶囊,危害食品安全的事件时有发生.请阅读下列信息,回答有关问题:
事件一:2011年4月11日晚,央视曝光“上海华联超市等销售染色馒头”,商家为了降低成本将柠檬黄用在玉米馒头中着色,山梨酸钾用在馒头中防止馒头发霉,甜蜜素用在馒头中代替蔗糖.面对记者的采访,而染色馒头的生产者对自己生产的馒头却说“我不会吃的,打死我都不会吃,饿死我都不会吃”.
事件二:2011年4月17日,沈阳警方端掉一黑豆芽加工点,老板称这种豆芽“旺季每天可售出2000斤”. 经检验这些“毒豆芽”中含有过量的亚硝酸钠、尿素等有害物质,其中尿素超标27倍,长期食用这种豆芽可致癌.
事件三:2012年4月16日国家食品药品监督管理局发出紧急通知,要求对修正药业等9个厂家,13个药用空心胶囊产品暂停销售和使用.经检验这些用工业明胶制成的胶囊中重金属铬含量超过国家标准规定2mg/kg的限量值,其中超标最多的达90多倍.
(1)馒头是我们的主食之一.食用馒头摄入体内的主要营养物质属于糖类,馒头中的主要成分是淀粉,它在人体内不能直接被吸收,而是在淀粉酶和水的作用下,转变成葡萄糖并溶解在血液中,生成的葡萄糖在体内经缓慢氧化放出热量供肌体活动,这一过程的化学反应方程式为C6H12O6+6O2═6CO2+6H2O.
(2)防腐剂山梨酸钾的化学式为C6H7KO2,试回答:
①山梨酸钾中C、H、K、O各元素的质量比为72:7:39:32;
②山梨酸钾中钾元素的质量分数为26.0%(结果保留1位小数).
(3)亚硝酸钠(NaNO2)是一种白色固体,有咸味,外观与氯化钠相似,有毒,过量或长期食用会对人体产生危害.有关氯化钠和亚硝酸钠的部分资料如表:
| 物质名称 | 水溶性 | 熔点 | 溶液的酸碱性 | 热稳定性 | 与稀盐酸作用 |
| 亚硝酸钠 | 易溶,在15℃时 溶解度为81.5g | 271℃ | 弱碱性 | 320℃以上会分解 放出刺激性气体 | 放出红棕色气体 |
| 氯化钠 | 易溶,在15℃时 溶解度为35.8g | 801℃ | 中性 | 受热不分解 | 不反应 |
②测定亚硝酸钠水溶液的pH约为C(填序号).
A.4 B.6.4 C.7.5 D.13
③工业用盐中常混有亚硝酸钠.为检验某食盐中是否含有亚硝酸钠,你的操作方法是取少量食盐于试管中,然后加热,若有刺激性气味的气体产生,就证明食盐中含有亚硝酸钠..
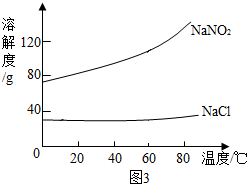
(4)如图3为氯化钠和亚硝酸钠的溶解度曲线,试回答:
①在20℃时,氯化钠饱和溶液中溶质的质量分数小于(填“大于”、“等于”、“小于”)亚硝酸钠的饱和溶液中溶质的质量分数.
②在20℃时,各取氯化钠和亚硝酸钠50g,分别加入到100g水中充分搅拌后,得到的亚硝酸钠溶液属于不饱和(填“饱和”或“不饱和”)溶液.
(5)食用铬含量超标的药品胶囊,会使人中毒的原因是铬是重金属,人体中具有生命活性的物质是蛋白质,当人体摄入重金属铬盐后,蛋白质的结构就会被破坏,生理活性随之消失.
分析 (1)根据馒头的主要成分是淀粉,淀粉属于糖类,葡萄糖和氧气通过缓慢氧化会生成二氧化碳和水进行分析;
(2)①根据元素质量比等于各元素的相对原子质量与原子个数乘积之比进行分析;
②根据钾元素的质量分数=$\frac{钾元素的质量}{山梨酸钾的相对分子质量}$×100%进行分析;
(3)①根据化学性质的定义进行分析;
②根据亚硝酸钠水溶液显弱碱性进行分析;
③根据亚硝酸钠受热会发生分解进行分析;
(4)①根据20℃时,氯化钠和亚硝酸钠的溶解度进行分析;
②根据20℃时,亚硝酸钠的溶解度进行分析;
(5)根据重金属能使蛋白质失去生理活性进行分析.
解答 解:(1)馒头是面粉制成的,主要成分是淀粉,淀粉属于糖类,葡萄糖和氧气通过缓慢氧化会生成二氧化碳和水,化学方程式为:C6H12O6+6O2═6CO2+6H2O;
(2)①元素质量比等于各元素的相对原子质量与原子个数乘积之比,所以山梨酸钾中C、H、K、O各元素的质量比为:(12×6):(7×1):(39×1):(16×2)=72:7:39:32;
②钾元素的质量分数=$\frac{钾元素的质量}{山梨酸钾的相对分子质量}$×100%=$\frac{39}{72+7+39+32}$×100%=26.0%;
(3)①化学性质是物质在发生化学变化表现出来的性质,所以亚硝酸钠的两条化学性质有:溶液呈弱碱性,不稳定受热易分解;
②亚硝酸钠水溶液显弱碱性,pH值略大于7,故选:C;
③亚硝酸钠受热会发生分解生成刺激性气体,所以检验某食盐中是否含有亚硝酸钠的操作方法是:取少量食盐于试管中,然后加热,若有刺激性气味的气体产生,就证明食盐中含有亚硝酸钠.或取少量食盐于试管中,然后向试管中加入稀盐酸,若有红棕色气体产生,就证明食盐中含有亚硝酸钠;
(4)①通过20℃时,氯化钠和亚硝酸钠的溶解度,亚硝酸钠的溶解度大于氯化钠的溶解度,所以氯化钠饱和溶液中溶质的质量分数小于亚硝酸钠的饱和溶液中溶质的质量分数;
②20℃时,亚硝酸钠的溶解度大于80g,所以各取氯化钠和亚硝酸钠50g,分别加入到100g水中充分搅拌后,得到的亚硝酸钠溶液属于不饱和溶液;
(5)重金属能使蛋白质失去生理活性,所以食用铬含量超标的药品胶囊,会使人中毒的原因是:铬是重金属,人体中具有生命活性的物质是蛋白质,当人体摄入重金属铬盐后,蛋白质的结构就会被破坏,生理活性随之消失.
故答案为:(1)糖类,淀粉,C6H12O6+6O2═6CO2+6H2O;
(2)①C:H:K:O=72:7:39:32;
②26.0%;
(3)①溶液呈弱碱性,不稳定受热易分解;
②C;
③取少量食盐于试管中,然后加热,若有刺激性气味的气体产生,就证明食盐中含有亚硝酸钠.或取少量食盐于试管中,然后向试管中加入稀盐酸,若有红棕色气体产生,就证明食盐中含有亚硝酸钠;
(4)①小于;
②不饱和;
(5)铬是重金属,人体中具有生命活性的物质是蛋白质,当人体摄入重金属铬盐后,蛋白质的结构就会被破坏,生理活性随之消失.
点评 解答本题的关键是要充分理解各种物质的性质,只有这样才能对问题做出正确的判断.

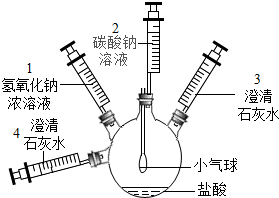 某实验小组设计了如图实验装置及方案,实验步骤如下,请回答有关问题:
某实验小组设计了如图实验装置及方案,实验步骤如下,请回答有关问题:第一步:注射器2中的溶液推入盛有稀盐酸烧瓶中,至不再有气泡产生,实验现象是小气球慢慢变瘪.
第二步:注射器 3 稍稍向外拉澄清石灰水变浑浊,反应方程式是CO2+Ca(OH)2═CaCO3↓+H2O.
第三步:注射器 1 中的溶液推入瓶中,气体鼓起
第四步:要证明瓶内气体被吸收完全的操作方法和判断依据是将注射器4稍稍向外拉,若澄清石灰水无明显现象,则证明瓶内气体被吸收完全.
第五步:注射器 4 中的溶液推入瓶中,反应方程式Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
第六步:完成上述实验后,小刘继续对瓶内溶液的成分进行了探究:
①提出猜想:溶液的溶质中一定含有 NaOH 和 NaCl,可能含有氢氧化钙或碳酸钠.
②实验验证:设计实验方案确定溶液中是否含有氢氧化钙,请补充完整下列
| 实验操作 | 实验现象 | 实验结论 |
| 取少量瓶内溶液于试管中,加入碳酸钠溶液,振荡 | 有白色沉淀生成 | 瓶内溶液中溶质的成分含有氢氧化钙 |
| A. | 40% | B. | 50% | C. | 56% | D. | 71.4% |
| A. | 合金比纯金属性能优越,但是它们的组成和结构相同 | |
| B. | 只有通过化学变化,才能获取新材料 | |
| C. | 复合材料的性能优于组成它的成分材料,是因为混合后组成和结构发生了变化 | |
| D. | 用于远距离、大容量信息传输的光导纤维属于有机高分子材料 |
| A. | 大量服用维生素药片有利人体健康 | B. | 糖类是人体主要的供能物质 | ||
| C. | 都是人体需要的营养物质 | D. | 都属于有机物 |

 化学物质之间的反应关系也可以构建出一些图形.将铝丝(经砂纸打磨)、稀盐酸、氢氧化钠溶液、氯化铜溶液这四种物质填在合适的位置上,其中C所表示的物质不是单质.(“-”连接的物质能反应,“→”连接的物质能转化)
化学物质之间的反应关系也可以构建出一些图形.将铝丝(经砂纸打磨)、稀盐酸、氢氧化钠溶液、氯化铜溶液这四种物质填在合适的位置上,其中C所表示的物质不是单质.(“-”连接的物质能反应,“→”连接的物质能转化)