题目内容
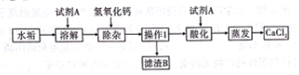
6. 如图是实验室常用气体制备装置,据图回答问题:
如图是实验室常用气体制备装置,据图回答问题:
(1)实验室用高锰酸钾制氧气的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,应选择发生和收集装置是AD或AF(填字母代号).若用如图装置排水法收集氧气,其具体操作为先将装置充满水,气体从b管进入.
(2)实验室制取二氧化碳的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
某化学学习小组同学用20%的过氧化氢溶液和二氧化锰,并选用 B 装置来制氧气.实验中,同学们发现不能得到平衡的氧气流.大家提出从两个方面加以改进:一是把发生装置由 B改为C,其理由是通过控制液体的滴加速度来控制反应的速率;二是将过氧化氢溶液加水稀释.溶液的稀释需要经过计算、量取、混匀三个步骤.如果把 50g 质量分数为 20%的过氧化氢溶液稀释成 5% 的过氧化氢溶液,需加水的质量为250g;在稀释过程中,除了烧杯外,还需要用到的仪器有①⑤⑥(填数字序号).
①量筒 ②药匙 ③试管 ④酒精灯 ⑤滴管 ⑥玻璃棒
(3)称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加50g稀盐酸,二者恰好完全反应.反应结束后称量烧杯中剩余物质的总质量为58.1g(不包含烧杯的质量,且气体的溶解忽略不计).试计算石灰石中杂质的质量分数.
分析 制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.有关溶液和化学方程式的计算要准确.
解答 解:(1)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;若用如图装置排水法收集氧气,其具体操作为:先将装置充满水,气体从b管进入;故答案为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;AD或AF;先将装置充满水,气体从b管进入;
(2)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;把B改为C,其理由是:通过控制液体的滴加速度来控制反应的速率;设需加水的质量为x,50g×20%=(50g+x)×5%,x=150g;在稀释过程中,除了烧杯外,还需要用到的仪器有:量筒、滴管、玻璃棒;故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;通过控制液体的滴加速度来控制反应的速率;250;①⑤⑥;
(3)根据质量守恒定律,二氧化碳的质量为:12.5g+50g-58.1g=4.4g;
设石灰石中碳酸钙的质量分数为x;
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
12.5g•x 4.4g
$\frac{100}{44}=\frac{12.5g•x}{4.4g}$ x=80%;
石灰石中杂质的质量分数=1-80%=20%;
答:石灰石中杂质的质量分数是20%;
故答案为:20%;
点评 本考点主要考查了有关溶液的配制、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关化学方程式的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

 如图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
如图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )| A. | 通过升温可以将甲、乙的不饱和溶液变为饱和溶液 | |
| B. | 20℃时分别将甲、乙的溶液蒸发掉向等质量的水,析出甲、乙的质量相等 | |
| C. | 10℃时,10g水中分别溶解甲、乙达到饱和,溶解较多的物质是乙 | |
| D. | 把100g溶质质量分数为10%的乙溶液从30℃降温到20℃,其质量分数仍为10% |
 请阅读下面的“节目单”并回答问题
请阅读下面的“节目单”并回答问题



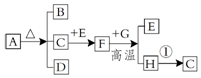

 已知ABCDE是初中化学常见的五种物质,其中A、D是黑色固体,B、C、E是无色气体,化合物D中含有金属元素,该金属元素的单质是世界年产量最高的金属.它们在一定条件下的转化关系如图所示(→表示转化).请回答下列问题:
已知ABCDE是初中化学常见的五种物质,其中A、D是黑色固体,B、C、E是无色气体,化合物D中含有金属元素,该金属元素的单质是世界年产量最高的金属.它们在一定条件下的转化关系如图所示(→表示转化).请回答下列问题: