题目内容
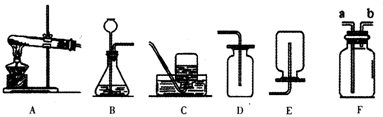
1.课本中对质量守恒定律的探究有如图所示的几种方案.
(1)写出三种方案中涉及的化学反应方程式:
甲:Fe+CuSO4=FeSO4+Cu.
乙:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
丙:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$ 2MgO.
(2)按照三种方案进行实验,反应前后天平的平衡状态各不相同.一段时间后甲中天平的状况是平衡(填“平衡”“左盘高”或“左盘低”).乙中盐酸倒入烧杯后天平的状况是左盘高(填“平衡”“左盘高”或“左盘低”)
(3)丙中,开始游码的读数是3g,取下镁带点燃完全燃烧以后,将得到的固体全部放回原盘,理论计算游码的读数是5g.
分析 根据盐酸与碳酸钠反应生成了二氧化碳气体,逸散到了空气中会使烧杯中物质的质量减少来分析解答;根据化学反应的实质来解释质量守恒的原因;
解答 解:(1)Fe+CuSO4=FeSO4+Cu;Na2CO3+2HCl═2NaCl+H2O+CO2↑;2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO
(2)化学反应前后,原子的种类不变,原子的数目没有增减,原子的质量也没有变化;盐酸与碳酸钠反应生成氯化钠、水、二氧化碳,而烧杯是敞开的,所以生成的二氧化碳逸散到空气中使质量减小,故左盘高,发生反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
故答案:平衡;左盘高.
(3)根据质量守恒生产氧化镁的质量等于镁的质量与反应的氧的质量之和.
故答案:5g.
点评 该题主要是利用质量守恒定律分析有气体生成和气体参加的反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11. 为测定某氮肥中硫酸铵的纯度(及质量分数)是否与如图标签相符合,小林取一定量该氮肥样品于烧杯中配成溶液与足量氯化钡溶液反应,记录有关数据如下表:
为测定某氮肥中硫酸铵的纯度(及质量分数)是否与如图标签相符合,小林取一定量该氮肥样品于烧杯中配成溶液与足量氯化钡溶液反应,记录有关数据如下表:
【反应的化学方程式为(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl,其他成分能溶于水但不参加反应】
(1)反应共生成BaSO4的质量为23.3g.
(2)若所取氮肥样品的质量为15g,试通过计算确定该氮肥中硫酸铵的纯度是否与标签相符.(请写出计算过程)
(3)反应前后,溶液中硫元素的质量是减小(填“不变”、“增大”或“减小”).
 为测定某氮肥中硫酸铵的纯度(及质量分数)是否与如图标签相符合,小林取一定量该氮肥样品于烧杯中配成溶液与足量氯化钡溶液反应,记录有关数据如下表:
为测定某氮肥中硫酸铵的纯度(及质量分数)是否与如图标签相符合,小林取一定量该氮肥样品于烧杯中配成溶液与足量氯化钡溶液反应,记录有关数据如下表:| 反应前 | 反应后 | |
| 烧杯和样品溶液总质量 | 氯化钡溶液质量 | 过滤后烧杯和溶液总质量(滤液的损失忽略不计) |
| 45g | 55g | 76.7g |
(1)反应共生成BaSO4的质量为23.3g.
(2)若所取氮肥样品的质量为15g,试通过计算确定该氮肥中硫酸铵的纯度是否与标签相符.(请写出计算过程)
(3)反应前后,溶液中硫元素的质量是减小(填“不变”、“增大”或“减小”).
10.株洲晚报2013年2月28日报道:“因厨房窗户紧闭,4名年轻人深夜煤气中毒,幸好被及时抢救,均脱离危险”.下列有关叙述正确的是( )
| A. | 引起煤气中毒的主要成分是CO2 | |
| B. | 在煤炉旁放一盆冷水,可以防止煤气中毒 | |
| C. | 为了便于及时发现煤气泄漏,煤气厂常在家用煤气中掺入微量具有难闻气味的气体 | |
| D. | 冬天用煤炉取暖时,为了防止冷空气进入,应关闭门窗 |
7.发生CO轻微中毒后(头昏),应立即做的是( )
| A. | 安排通风口,改善排气状况 | B. | 打开门窗,使房间通风 | ||
| C. | 用冷水淋头 | D. | 用湿毛巾捂住鼻子,跑出房间 |
 已知A、B、C、D、E是初中化学中常见的五种物质,均含有同一种元素,其中,只有E为单质,C和D含有的元素完全相同,A、B是常见的建筑材料的主要成分,它们在一定条件下的转化关系如图所示(反应条件和部分反应物、生成物已省略),请回答:
已知A、B、C、D、E是初中化学中常见的五种物质,均含有同一种元素,其中,只有E为单质,C和D含有的元素完全相同,A、B是常见的建筑材料的主要成分,它们在一定条件下的转化关系如图所示(反应条件和部分反应物、生成物已省略),请回答: 用如图所示的玻璃管进行碳还原氧化铜实验.
用如图所示的玻璃管进行碳还原氧化铜实验.