题目内容
8.如图,请回答: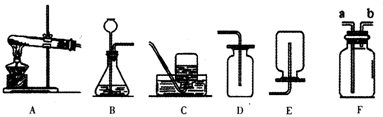
①实验室制取二氧化碳应选用的气体发生装置是B收集装置是D(不选F)
②使用长颈漏斗的好处是随时添加液体
③长颈漏斗伸入液面以下的原因是:防止生成的二氧化碳气体从长颈漏斗逸出
④常用二氧化碳作灭火剂的原因是①二氧化碳密度比空气大;②不助燃,不可燃.
分析 ①根据实验室制取二氧化碳的反应是固体和液体,反应条件是常温,二氧化碳密度比空气大,易溶于水进行分析;
②根据使用长颈漏斗可以随时添加液体进行分析;
③根据长颈漏斗伸入液面以下的原因是防止生成的二氧化碳从长颈漏斗中逸出进行分析;
④根据二氧化碳的性质进行分析.
解答 解:①实验室制取二氧化碳的反应是固体和液体,反应条件是常温,所以发生装置是B,二氧化碳密度比空气大,易溶于水,所以收集装置是D;
②使用长颈漏斗可以随时添加液体;
③长颈漏斗伸入液面以下的原因是防止生成的二氧化碳从长颈漏斗中逸出;
④常用二氧化碳作灭火剂的原因是:二氧化碳密度比空气大,不助燃,不可燃.
故答案为:①B,D;
②随时添加液体;
③防止生成的二氧化碳从长颈漏斗中逸出;
④二氧化碳密度比空气大,不助燃,不可燃.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

练习册系列答案
相关题目
16.铝合金是工业中应用最广泛的一类有色金属结构材料,在航空、航天、汽车、机械制造、船舶及化学工业中已大量应用.工业经济的飞速发展,对铝合金的需求日益增多,使铝合金的研究也随之深入.已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
查阅资料:铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有铜(填名称).
猜想3:该合金粉末中除铝外,还含有铁、铜.
实验探究:下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
探究结论:猜想3成立.
反思:一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.写出铝与稀盐酸反应的化学方程式2Al+6HCl═2AlCl3+3H2↑.
【拓展与分析】(注意:若答对本小题奖励4分,化学总分不超过60分)
请设计两个不同的实验方案,验证铝、铜的金属活动性强弱.
方案一:将铝丝和铜丝分别插入稀盐酸中,观察现象;
方案二:铝丝插入硫酸铜溶液中,观察现象.
【总结归纳】由上述实验得出比较金属活动性强弱的方法有:
①通过金属与酸反应比较;②通过金属与盐溶液反应比较.
查阅资料:铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有铜(填名称).
猜想3:该合金粉末中除铝外,还含有铁、铜.
实验探究:下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的30%的氢氧化钠溶液 ,充分反应后过滤,滤渣备用. | 粉末部分溶解,并有气体放出. | 合金中一定含有铝. |
| ②取步骤①所得滤渣,加过量的10%盐酸 ,充分反应. | 滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有铁和铜. |
反思:一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.写出铝与稀盐酸反应的化学方程式2Al+6HCl═2AlCl3+3H2↑.
【拓展与分析】(注意:若答对本小题奖励4分,化学总分不超过60分)
请设计两个不同的实验方案,验证铝、铜的金属活动性强弱.
方案一:将铝丝和铜丝分别插入稀盐酸中,观察现象;
方案二:铝丝插入硫酸铜溶液中,观察现象.
【总结归纳】由上述实验得出比较金属活动性强弱的方法有:
①通过金属与酸反应比较;②通过金属与盐溶液反应比较.
3.下列有关实验现象描述正确的是( )
| A. | 红磷在氧气中燃烧,产生大量白雾 | |
| B. | 木炭在氧气中剧烈燃烧,发白光,生成二氧化碳 | |
| C. | 硫在氧气中燃烧,发出蓝紫色火焰,生成无色无味气体 | |
| D. | 铁丝在氧气中燃烧,剧烈燃烧,火星四射,生成黑色固体 |
17.除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是( )
| 物质 | 杂质 | 除杂质应选用的试剂和操作方法 | |
| A | HCl气体 | CO2气体 | 先通过氢氧化钠溶液,再通过浓硫酸 |
| B | NaOH固体 | Na2CO3固体 | 加入过量盐酸,蒸发 |
| C | Cu(NO3)2溶液 | AgNO3溶液 | 加入过量的铜粉,过滤 |
| D | Fe | Cu | 加入适量的CuSO4溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |

