题目内容
9.A-F是初中化学常见的六种物质,A和B是由相同元素组成的不同物质,B、E为氧化物,C、D和F(红色)都是单质.它们相互转化的关系如图所示,根据图示解答下列问题: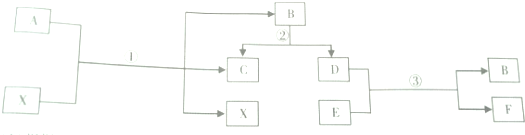
(1)根据上述信息,推出A→F六种物质的化学式:
AH2O2,BH2O,CO2,DH2,ECuO,FCu.
(2)X在化学反应①中,所起的作用可能是催化作用.
(3)写出上述①、②、③的三个化学反应方程式:
①2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
③H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O.
分析 根据A和B是由相同元素组成的不同物质,B为氧化物,C、D都是单质,因此A是过氧化氢,B是水,过氧化氢在二氧化锰的作用下产生水和氧气,因此X是过氧化氢,C是氧气,则D是氢气;E为氧化物,F(红色)是单质,可知E为氧化铜,F为铜;带入验证完成相关的问题.
解答 解:A和B是由相同元素组成的不同物质,B为氧化物,C、D都是单质,因此A是过氧化氢,B是水,过氧化氢在二氧化锰的作用下产生水和氧气,因此X是过氧化氢,C是氧气,则D是氢气;E为氧化物,F(红色)是单质,可知E为氧化铜,F为铜;带入验证符合转化关系,因此:
(1)A是过氧化氢,B是水,C是氧气,D是氢气,E是氧化铜,F是铜;故填:H2O2;H2O;O2;H2;CuO;Cu;
(2)过氧化氢分解生成水和氧气,因此X可以是二氧化锰,起到催化作用;故填:催化作用;
(3)过氧化氢在二氧化锰的催化作用下生成水和氧气,水通电分解生成氢气和氧气,氢气和氧化铜在加热的条件下生成铜和水,故方程式分别为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
相关题目
17.建立宏观、微观和符号之间的联系有重要意义.
(1)如图物质是由不同粒子构成的,请用化学符号表示出构成这些物质的粒子.
(2)N(NO2)3是科学家2011年发现的一种新型火箭燃料.计算N(NO2)3的相对分子质量为152,N(NO2)3中氮元素和氧元素的质量比为7:12(结果用最简整数比表示),N(NO2)3中氮元素的质量分数为36.8%(最终结果保留一位小数).
(1)如图物质是由不同粒子构成的,请用化学符号表示出构成这些物质的粒子.
 生命之源-水 |  新型金属材料 纳米铜 |  食盐的主要成分氯化钠 |
| 构成的粒子是H2O | 构成的粒子是Cu | 构成的粒子是Na+、Cl- |
14.下列关下物质电离的说法中正确的是( )
| A. | 电离产生的阴、阳离子个数相等 | |
| B. | 阳离子所带正电荷数等于阴离子所带的负电荷数 | |
| C. | 阴、阳离子所带负电荷总数与正电荷总数相等 | |
| D. | 物质电离后,溶液对外显电性 |
16.铝合金是工业中应用最广泛的一类有色金属结构材料,在航空、航天、汽车、机械制造、船舶及化学工业中已大量应用.工业经济的飞速发展,对铝合金的需求日益增多,使铝合金的研究也随之深入.已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
查阅资料:铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有铜(填名称).
猜想3:该合金粉末中除铝外,还含有铁、铜.
实验探究:下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
探究结论:猜想3成立.
反思:一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.写出铝与稀盐酸反应的化学方程式2Al+6HCl═2AlCl3+3H2↑.
【拓展与分析】(注意:若答对本小题奖励4分,化学总分不超过60分)
请设计两个不同的实验方案,验证铝、铜的金属活动性强弱.
方案一:将铝丝和铜丝分别插入稀盐酸中,观察现象;
方案二:铝丝插入硫酸铜溶液中,观察现象.
【总结归纳】由上述实验得出比较金属活动性强弱的方法有:
①通过金属与酸反应比较;②通过金属与盐溶液反应比较.
查阅资料:铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有铜(填名称).
猜想3:该合金粉末中除铝外,还含有铁、铜.
实验探究:下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的30%的氢氧化钠溶液 ,充分反应后过滤,滤渣备用. | 粉末部分溶解,并有气体放出. | 合金中一定含有铝. |
| ②取步骤①所得滤渣,加过量的10%盐酸 ,充分反应. | 滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有铁和铜. |
反思:一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.写出铝与稀盐酸反应的化学方程式2Al+6HCl═2AlCl3+3H2↑.
【拓展与分析】(注意:若答对本小题奖励4分,化学总分不超过60分)
请设计两个不同的实验方案,验证铝、铜的金属活动性强弱.
方案一:将铝丝和铜丝分别插入稀盐酸中,观察现象;
方案二:铝丝插入硫酸铜溶液中,观察现象.
【总结归纳】由上述实验得出比较金属活动性强弱的方法有:
①通过金属与酸反应比较;②通过金属与盐溶液反应比较.
 写出如图所示的二氧化碳灭火实验说明了二氧化碳的物理性质与化学性质各一条.
写出如图所示的二氧化碳灭火实验说明了二氧化碳的物理性质与化学性质各一条.
