题目内容
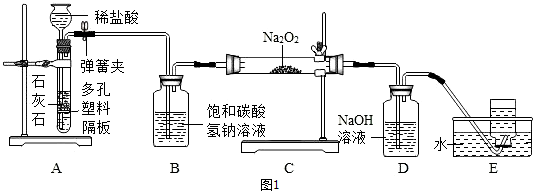
7.如图1所示,某学习小组围绕“气体的实验室制取”进行研讨,请你参与完成下面的问题.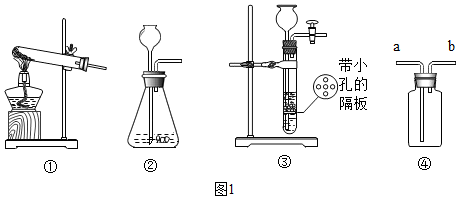
(1)如图①装置制取气体的适用条件是反应物是固体,反应需要加热.
(2)图③装置相比图②装置的主要优点是能随时控制反应的开始和结束.
(3)实验室主要锌粒与稀H2SO4反应制取H2,该反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑.
(4)实验室若用图④装置收集NH3,气体应从b端通入.(填字母)
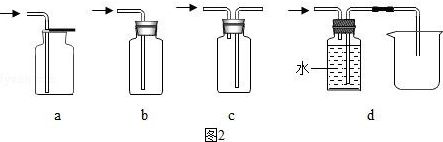
(5)为了测定铜元素的相对原子质量Ar(Cu),某同学以氢气还原氧化铜的反应设计了:图2中第一个装有碱石灰的U形管的作用是吸收氢气中的水蒸气.若测得反应前氧化铜的质量为a g,实验完成后第二个装有碱石灰的U形管增加的质量为b g,则Ar(Cu)=$\frac{18a}{b}$-16.(用a、b表示)
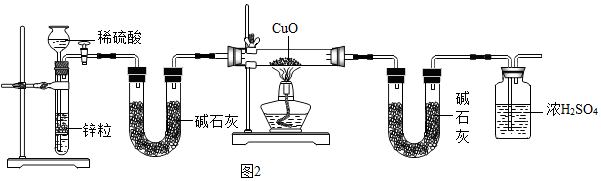
(6)请写出利用装置②制取O2的化学反应方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
分析 (1)根据反应物的状态和反应条件选择发生装置进行分析;
(2)根据装置内外产生的气压差可以控制反应的发生和停止进行分析;
(3)根据锌和稀硫酸反应生成硫酸锌和氢气进行分析;
(4)根据氨气的密度比空气小进行分析;
(5)根据通入硬试管中的氢气要干燥,第一个装有碱石灰的U形管的作用是除去氢气中的水分;由装置图与实验原理可知,第二个装有碱石灰的U形管的作用是用于吸收反应产生的水,根据水的质量测定铜元素的相对原子质量Ar(Cu);
(6)根据过氧化氢在二氧化锰的催化作用下生成水和氧气进行分析.
解答 解:(1)初中所学发生装置主要分两种,即固体加热型、固体和液体不加热型.A装置属于固体和固体加热装置,反应物是固体和固体,反应条件是加热;
(2)实验室用大理石和稀盐酸制取二氧化碳,发生装置属于固体和液体不加热制气体;②和③相比,③装置中导管多了一个开关,一旦开关关闭,随着气体的增多,迫使液体和多孔隔板上的固体分离,导致反应停止;
(3)锌和稀硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2↑;
(4)因为氨气易溶于水,密度比空气小,故采用向下排空气法收集,所以从短管(b)通入,把空气从长管排出;
(5)通入硬试管中的氢气要干燥,第一个装有碱石灰的U形管的作用是除去氢气中的水分;依据H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
氧化铜的质量为ag,反应后生成水的质量为bg,令铜的相对原子质量为x,则(x+16):18=ag:bg,解得x=$\frac{18a}{b}$-16;
(6)过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
故答案为:(1)反应物是固体,反应需要加热;
(2)能随时控制反应的开始和结束;
(3)Zn+H2SO4=ZnSO4+H2↑;
(4)b;
(5)吸收氢气中的水蒸气,$\frac{18a}{b}$-16;
(6)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

| A. | FeCl3 | B. | CuSO4 | C. | FeCl2 | D. | HgCl |
| A. | 观察气体颜色 | B. | 闻气体的气味 | C. | 插入燃着的木条 | D. | 倒入澄清石灰水 |
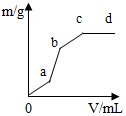 向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入溶液的体积V之间的关系如图所示,关于该曲线的推测正确的是( )
向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入溶液的体积V之间的关系如图所示,关于该曲线的推测正确的是( )| A. | a-b产生的沉淀为硫酸钡 | |
| B. | a-b产生的沉淀为氢氧化镁 | |
| C. | b-c产生的沉淀为硫酸钡和氢氧化镁 | |
| D. | b-c产生的沉淀为氢氧化镁 |
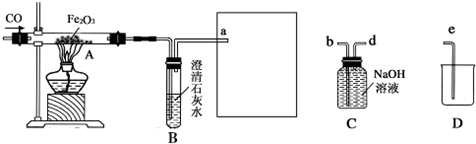
 如图是某同学设计的趣味实验装置,其气密性良好.
如图是某同学设计的趣味实验装置,其气密性良好.