题目内容
18.某化学兴趣小组用一氧化碳与氧化铁的反应来探究炼铁的原理,装置如图所示.请回答有关问题: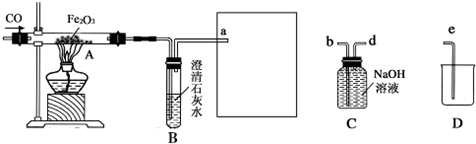
(1)为避免一氧化碳污染空气,并回收利用一氧化碳,方框中连接的是C和D,导管接口的连接顺序为a→(d)→(b)→(e);
(2)实验开始时,应先通一氧化碳后再加热,目的是赶尽玻璃管内的空气,防止加热时爆炸;
(3)实验进行一段时间后,玻璃管A中出现的现象为红色固体变为黑色,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
分析 (1)根据一氧化碳的密度比水小分析解答;
(2)根据一氧化碳易可燃,容易发生爆炸考虑;
(3)根据实验现象的描述和方程式的书写方法考虑.
解答 解:(1)一氧化碳需要从d端进去,从b端将溶液排出,连接e,将排出的液体排到D中,故填:d,b,e;
(2)因为一氧化碳具有可燃性,能和氧气混合在点燃的条件下会发生爆炸,所以实验开始时应先通一氧化碳再加热,目的是赶尽玻璃管内的空气,防止加热爆炸;故填:赶尽玻璃管内的空气,防止加热时爆炸;
(3)氧化铁和一氧化碳在高温条件下反应能生成铁和二氧化碳,所以现象是红色固体变为黑色,反应物是一氧化碳和氧化铁,生成物是铁和二氧化碳,根据得失氧进行配平,反应条件是高温,所以方程式是:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.故填:红色固体变为黑色;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
点评 本题主要考查一氧化碳与氧化铁反应实验装置、实验现象、一氧化碳的化学性质和污染及能源的再利用,难度稍大.

练习册系列答案
相关题目
10.下列说法不正确的是( )
| A. | 食盐不是盐 | B. | 纯碱不是碱 | C. | 水银不是银 | D. | 干冰不是冰 |
6.现在许多食品都采用密封包装,但包装袋中的空气、水蒸气仍会使食品氧化、受潮变质,因此一些食品包装袋中需放入一些脱氧剂,以使食品保质期更长一些.
甲、乙、丙三同学为了探究“脱氧剂”的成分,从某食品厂的月饼包装袋中取出“脱氧剂”一袋,打开封口,将其倒在滤纸上,仔细观察,脱氧剂为灰黑色粉末,还有少量的红色粉末.
提出问题:该脱氧剂中的灰黑色、红色粉末各是什么?
猜想:甲同学认为:灰黑色粉末可能是氧化铜、红色粉末可能是铜.
乙同学认为:灰黑色粉末可能是铁粉,也可能还有少量的活性炭粉;红色物质是氧化铁.
丙同学认为:灰黑色物质可能是氧化铜、活性炭粉,红色粉末可能是铜.
(1)你认为乙同学的猜想正确,其理由是因为铁是化学性质较活泼的金属,尤其是铁粉颗粒小,常温下更易与空气中的氧气、水蒸气反应而生锈.
(2)设计一个实验方案来验证该同学对灰黑色粉末的猜想是正确的.请填写以下实验报告:
(3)写出B装置中发生反应的化学方程式Fe203+3H2SO4=Fe2(SO4)3十3H2O;Fe2(SO4)3+6NaOH═2Fe(OH)3↓+3Na2SO4.
甲、乙、丙三同学为了探究“脱氧剂”的成分,从某食品厂的月饼包装袋中取出“脱氧剂”一袋,打开封口,将其倒在滤纸上,仔细观察,脱氧剂为灰黑色粉末,还有少量的红色粉末.
提出问题:该脱氧剂中的灰黑色、红色粉末各是什么?
猜想:甲同学认为:灰黑色粉末可能是氧化铜、红色粉末可能是铜.
乙同学认为:灰黑色粉末可能是铁粉,也可能还有少量的活性炭粉;红色物质是氧化铁.
丙同学认为:灰黑色物质可能是氧化铜、活性炭粉,红色粉末可能是铜.
(1)你认为乙同学的猜想正确,其理由是因为铁是化学性质较活泼的金属,尤其是铁粉颗粒小,常温下更易与空气中的氧气、水蒸气反应而生锈.
(2)设计一个实验方案来验证该同学对灰黑色粉末的猜想是正确的.请填写以下实验报告:
| 实验步骤 | 预期的实验现象 | 结论 |
| ①用磁铁充分接触滤纸上的脱氧剂粉末; ②将红色物质放入小试管中,加入足量稀硫酸观察现象.继续滴加足量的NaOH溶液. | 绝大部分黑色粉末被吸引 红色物质溶解,溶液呈黄色,产生红褐色沉淀 | 脱氧剂的成分是铁粉 红色物质是Fe203 |
13.对于化学反应A+B═C+D,下列说法中错误的是( )
| A. | 若A.C是单质,B.D是化合物,则该反应一定是置换反应 | |
| B. | 若A是可溶性碱,B是可溶性盐,则C.D可能是两种沉淀 | |
| C. | 若生成物C、D分别是盐和水,则反应物A、B一定是酸和碱 | |
| D. | 若A、B各取10g混合,使其充分反应,则C、D质量的总和不一定等于20g |
3.各组物质能反应,而且充分反应后所得溶液的质量比反应前溶液的总质量增大的是( )
| A. | 铝和硫酸铜溶液 | B. | 氯化钠溶液和稀硫酸 | ||
| C. | 把二氧化碳通入澄清的石灰水 | D. | 碳酸钙固体和稀盐酸 |