题目内容
废物利用不仅可以保护环境,还可以节约资源.如图是某化学兴趣小组对废旧电池的回收利用,请回答下列问题:
【实验 1】回收填料中的二氧化锰和氯化铵
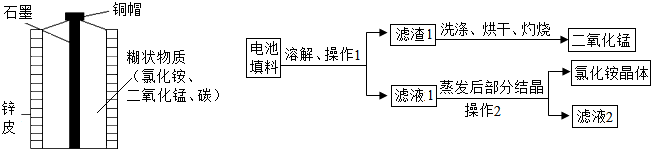
(1)操作 1 和操作 2中玻璃棒的作用是 ;
(2)灼烧滤渣 1 的目的是 ;
(3)在上述物质中,在实验室制取氧气的反应中可用作催化剂的是 ,含氮元素且可作氮肥的是 ;
(4)在某温度下蒸发滤液 1 时,大量的氯化铵晶体析出的原因是 .
【实验 2】利用外壳回收物锌制取氢气及相关探究
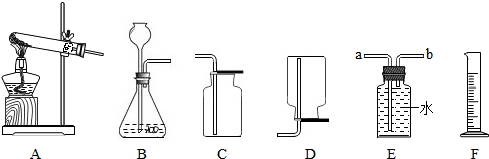
(5)用锌和稀硫酸制取氢气.己知氢气密度比空气小且难溶于水.
①装置选择:选择的发生装置为 (填编号),要收集比较干燥的气体,应选用的收集装置为 (填编号).
②若用排水法收集并测定气体的体积,气体从装置 E导管口 (填“a”或“b”) 进;选用仪器 F 测量排出水的体积,仪器 F 名称是 ,若选用50ml的量筒,收集完毕量筒中剩余4ml,则收集的气体为 .
(6)探究影响锌与稀硫酸反应快慢的因素.如表是小明分别用相同质量的锌和足量的稀硫酸反应的四组实验数据:
①比较实验Ⅰ和实验Ⅱ,可以得到的结论是 .
②为了研究硫酸浓度对反应快慢的影响,需比较实验 和实验 (填编号).
③实验Ⅲ和Ⅳ标明该反应快慢与 有关;
④如果把实验Ⅱ中硫酸的质量分数改为4%,请你推测锌消失的时间(用t表示)的取值范围
⑤该实验除了用锌消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗? .
【实验 1】回收填料中的二氧化锰和氯化铵

(1)操作 1 和操作 2中玻璃棒的作用是
(2)灼烧滤渣 1 的目的是
(3)在上述物质中,在实验室制取氧气的反应中可用作催化剂的是
(4)在某温度下蒸发滤液 1 时,大量的氯化铵晶体析出的原因是
【实验 2】利用外壳回收物锌制取氢气及相关探究
(5)用锌和稀硫酸制取氢气.己知氢气密度比空气小且难溶于水.
①装置选择:选择的发生装置为
②若用排水法收集并测定气体的体积,气体从装置 E导管口

(6)探究影响锌与稀硫酸反应快慢的因素.如表是小明分别用相同质量的锌和足量的稀硫酸反应的四组实验数据:
| 实验序号 | 不同纯度的锌 | 硫酸的质量分数/% | 反应温度/℃ | 锌消失的时间/s |
| Ⅰ | 含杂质锌 | 3 | 20 | 200 |
| Ⅱ | 纯锌 | 3 | 20 | 500 |
| Ⅲ | 纯锌 | 6 | 20 | 300 |
| Ⅳ | 纯锌 | 6 | 30 | 80 |
②为了研究硫酸浓度对反应快慢的影响,需比较实验
③实验Ⅲ和Ⅳ标明该反应快慢与
④如果把实验Ⅱ中硫酸的质量分数改为4%,请你推测锌消失的时间(用t表示)的取值范围
⑤该实验除了用锌消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?
考点:混合物的分离方法,影响化学反应速率的因素探究,过滤的原理、方法及其应用,结晶的原理、方法及其应用,氢气的制取和检验
专题:物质的分离和提纯,常见气体的实验室制法、检验、干燥与净化,科学探究
分析:根据已有的知识进行分析,过滤中玻璃棒起到了引流的作用;蒸发中玻璃棒起到了搅拌、使液体均匀受热的作用;滤渣1中含有二氧化锰和炭,灼烧是为了除去炭;发生装置的选择取决于反应物的状态和反应的条件;根据实验提供的数据进行分析比较影响化学反应的速率,据此解答.
解答:解:(1)操作1是过滤,玻璃棒起到了引流的作用,操作2是蒸发,玻璃棒起到了搅拌、使液体均匀受热的作用,故填:引流;搅拌、使液体均匀受热;
(2)过滤得到的滤渣l中含有炭,灼烧能使碳与氧气反应生成二氧化碳从而除去,故填:除去炭粉;
(3)在上述物质中,二氧化锰在实验室制取氧气的反应中可用作催化剂,氯化铵含氮元素且可作氮肥,故填:二氧化锰,氯化铵;
(4)在某温度下蒸发滤液1时,首先形成氯化铵的饱和溶液,继续蒸发,水分减少,氯化铵溶解不了,就结晶析出,故填:形成了氯化铵的饱和溶液;
(5)用锌和稀硫酸制取氢气.己知氢气密度比空气小且难溶于水.
①锌是固体,稀硫酸是液体,该反应在常温下可以进行,选择的发生装置为B;氢气的密度比空气小,要收集比较干燥的气体,应选用的收集装置为D,故填:B,D;
②若用排水法收集并测定气体的体积,则需要将E中的水排出,气体从装置E导管口b进;选用仪器F测量排出水的体积,仪器F是量筒;若选用50ml的量筒,收集完毕量筒中剩余4ml,则收集的气体为50-4=46mL,故填:b,量筒,46mL;
(6)①比较实验Ⅰ和实验Ⅱ,不同的是锌的纯度,可以看出含杂质的锌消失的时间少,可以得到的结论是含杂质的锌与稀硫酸反应的快,故填:含杂质的锌与稀硫酸反应的快;
②为了研究硫酸浓度对反应快慢的影响,需比较实验Ⅱ和实验Ⅲ,故填:Ⅱ,Ⅲ;
③实验Ⅲ和Ⅳ标明该反应快慢与温度有关,故填:温度;
④如果把实验Ⅱ中硫酸的质量分数改为4%,介于3%和6%之间,则锌消失的时间比3%的硫酸快,比6%的硫酸慢,时间介于200~300之间,故填:200~300;
⑤该实验除了用锌消失的时间来衡量反应的快慢外,还可用相同的时间内产生的氢气的体积来衡量该反应的快慢,故填:相同的时间内产生的氢气的体积来衡量该反应的快慢.
(2)过滤得到的滤渣l中含有炭,灼烧能使碳与氧气反应生成二氧化碳从而除去,故填:除去炭粉;
(3)在上述物质中,二氧化锰在实验室制取氧气的反应中可用作催化剂,氯化铵含氮元素且可作氮肥,故填:二氧化锰,氯化铵;
(4)在某温度下蒸发滤液1时,首先形成氯化铵的饱和溶液,继续蒸发,水分减少,氯化铵溶解不了,就结晶析出,故填:形成了氯化铵的饱和溶液;
(5)用锌和稀硫酸制取氢气.己知氢气密度比空气小且难溶于水.
①锌是固体,稀硫酸是液体,该反应在常温下可以进行,选择的发生装置为B;氢气的密度比空气小,要收集比较干燥的气体,应选用的收集装置为D,故填:B,D;
②若用排水法收集并测定气体的体积,则需要将E中的水排出,气体从装置E导管口b进;选用仪器F测量排出水的体积,仪器F是量筒;若选用50ml的量筒,收集完毕量筒中剩余4ml,则收集的气体为50-4=46mL,故填:b,量筒,46mL;
(6)①比较实验Ⅰ和实验Ⅱ,不同的是锌的纯度,可以看出含杂质的锌消失的时间少,可以得到的结论是含杂质的锌与稀硫酸反应的快,故填:含杂质的锌与稀硫酸反应的快;
②为了研究硫酸浓度对反应快慢的影响,需比较实验Ⅱ和实验Ⅲ,故填:Ⅱ,Ⅲ;
③实验Ⅲ和Ⅳ标明该反应快慢与温度有关,故填:温度;
④如果把实验Ⅱ中硫酸的质量分数改为4%,介于3%和6%之间,则锌消失的时间比3%的硫酸快,比6%的硫酸慢,时间介于200~300之间,故填:200~300;
⑤该实验除了用锌消失的时间来衡量反应的快慢外,还可用相同的时间内产生的氢气的体积来衡量该反应的快慢,故填:相同的时间内产生的氢气的体积来衡量该反应的快慢.
点评:本题考查了物质的分离与提纯以及气体制取和影响化学反应因素的实验探究,完成此题,可以依据已有的知识结合题干提供的信息进行.

练习册系列答案
相关题目
下列关于回收铝饮料罐说法不正确的是( )
| A、回收铝饮料罐可以节约金属资源 |
| B、回收一个铝饮料罐比制造一个铝饮料罐要贵 |
| C、回收铝饮料罐可以减少对环境的污染 |
| D、回收铝饮料罐可以节约能源 |
人体中化学元素含量的多少会直接影响人体健康.下列人体所缺元素与引起的健康问题关系错误的是( )
| A、缺钙会引起侏儒症 |
| B、缺碘会引起甲状腺疾病 |
| C、缺铁 易得贫血症 |
| D、缺锌会使儿童发育停滞 |

 实验室中有一瓶标签受损的无色液体,如图所示.这瓶无色液体是什么呢?
实验室中有一瓶标签受损的无色液体,如图所示.这瓶无色液体是什么呢? A、B、C、D、E为初中五种常见物质,其中A是生活中最常见液体,B、D是气体,只有E含金属元素,B是常见单质(反应条件与其他物质均已略去).“→”表示按方向一步转化,“--”表示两种物质间可以发生反应,所有反应都是初中常见反应.
A、B、C、D、E为初中五种常见物质,其中A是生活中最常见液体,B、D是气体,只有E含金属元素,B是常见单质(反应条件与其他物质均已略去).“→”表示按方向一步转化,“--”表示两种物质间可以发生反应,所有反应都是初中常见反应.