题目内容
10.将硫酸氢钠溶液滴入盛有锌粒的试管中,可以观察到锌粒表面有气泡产生,该反应的化学方程式为:Zn+2NaHSO4=ZnSO4+Na2SO4+H2↑,某同学就该实验的现象及反应化学方程式,得出以下结论,其中正确的是( )| A. | 单质跟化合物反应生成新的单质和新的化合物的反应一定是置换反应 | |
| B. | 硫酸氢钠电离时产生的阳离子含氢离子,故硫酸氢钠溶液呈酸性 | |
| C. | 上述反应中,金属锌变成锌离子进入溶液,实际上是金属得到了电子 | |
| D. | 硫酸氢钠与金属锌反应后的产物是盐和氢气,符合酸的共性,硫酸氢钠属于酸类 |
分析 A、根据置换反应的定义进行分析;
B、根据酸性溶液的特征进行分析;
C、根据锌由原子变为离子的方法进行分析;
D、根据酸的定义,电离时,电离出来的阳离子全部是氢离子的化合物属于酸进行分析.
解答 解:A、置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,该反应的生成物中含有两种化合物,所以不属于置换反应,故A错误;
B、硫酸氢钠电离时产生的阳离子中含有氢离子,因此溶液呈酸性,故B正确;
C、锌由原子变为离子失去两个电子,故C错误;
D、电离时,电离出来的阳离子全部是氢离子的化合物属于酸,硫酸氢钠电离出来的阳离子中不仅含有氢离子,还含有钠离子,不属于酸,属于盐,故D错误.
故选:B.
点评 本题属于信息题的考查,解答本题关键是要知道置换反应的定义,熟悉酸、碱、盐的定义和判断方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.妈妈买了一瓶爽肤水,小丽打开一看发现爽肤水是一种蓝色溶液,小丽怀疑其中含有硫酸铜,欲通过检测硫酸根离子来进行初步判断,她应选用的试剂是( )
| A. | BaCl2溶液和稀HNO3 | B. | 紫色石蕊试液 | ||
| C. | NaOH溶液 | D. | NaCl溶液和稀HNO3 |
18.科学研究发现:三氧二碳(C2O3)是金星大气层的成分之一,其化学性质与一氧化碳极其相似.三氧化二碳不一定具有的化学性质是( )
| A. | C2O3能使人中毒 | B. | C2O3能在O2中充分燃烧生成CO2 | ||
| C. | C2O3在一定条件下能还原氧化铁 | D. | C2O3能使澄清石灰水变浑浊 |
2.下列固体在空气中易潮解,并能吸收空气中的CO2,该产物的晶体在干燥的空气中会风化的是( )
| A. | NaCl | B. | 生石灰 | C. | 烧碱 | D. | 纯碱 |
20. 探究小组利用如图装置进行四组实验,胶头滴管盛装的是液体,烧瓶中盛装的是气体、固体或液体,当滴管滴几滴液体后,能观察到气球变大的实验组合是( )
探究小组利用如图装置进行四组实验,胶头滴管盛装的是液体,烧瓶中盛装的是气体、固体或液体,当滴管滴几滴液体后,能观察到气球变大的实验组合是( )
 探究小组利用如图装置进行四组实验,胶头滴管盛装的是液体,烧瓶中盛装的是气体、固体或液体,当滴管滴几滴液体后,能观察到气球变大的实验组合是( )
探究小组利用如图装置进行四组实验,胶头滴管盛装的是液体,烧瓶中盛装的是气体、固体或液体,当滴管滴几滴液体后,能观察到气球变大的实验组合是( ) | 组合 | A | B | C | D |
| 滴管中 | Na2CO3 | HCl | NaOH | H2SO4(浓) |
| 烧瓶中 | HCl(液) | Zn(固) | CO2(气) | H2O(液) |
| A. | A | B. | B | C. | C | D. | D |
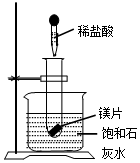 (1)向试管中放入几小粒镁片,把试管底部伸入盛有饱和石灰水(20℃的烧杯中并固定,再向试管中滴入约5ml盐酸,如图所示,结果澄清的饱和石灰水明显变浑浊,这个实验现象产生原因是镁与盐酸反应放出热量使石灰水的温度升高,氢氧化钙的溶解度随温度的升高减小,所以会析出晶体.
(1)向试管中放入几小粒镁片,把试管底部伸入盛有饱和石灰水(20℃的烧杯中并固定,再向试管中滴入约5ml盐酸,如图所示,结果澄清的饱和石灰水明显变浑浊,这个实验现象产生原因是镁与盐酸反应放出热量使石灰水的温度升高,氢氧化钙的溶解度随温度的升高减小,所以会析出晶体.