题目内容
20. 探究小组利用如图装置进行四组实验,胶头滴管盛装的是液体,烧瓶中盛装的是气体、固体或液体,当滴管滴几滴液体后,能观察到气球变大的实验组合是( )
探究小组利用如图装置进行四组实验,胶头滴管盛装的是液体,烧瓶中盛装的是气体、固体或液体,当滴管滴几滴液体后,能观察到气球变大的实验组合是( ) | 组合 | A | B | C | D |
| 滴管中 | Na2CO3 | HCl | NaOH | H2SO4(浓) |
| 烧瓶中 | HCl(液) | Zn(固) | CO2(气) | H2O(液) |
| A. | A | B. | B | C. | C | D. | D |
分析 分析装置的原理:要使气球变大就要使瓶中的气体减少或瓶中温度降低.可以根据物质之间混合时的反应特点方面进行分析、判断.
解答 解:A、碳酸钠与盐酸反应生成二氧化碳气体,气球变小,故A不符合题意;
B、稀盐酸和锌反应生成氢气,气球变小,故B不符合题意;
C、二氧化碳能和氢氧化钠溶液反应生成碳酸钠和水,所以气球变大,故C符合题意;
D、浓硫酸溶于水放热,所以气球会变小,故D不符合题意.
故选C.
点评 本题主要考查了酸、碱、盐的化学性质,解此类题的关键是分析装置的原理,再根据酸、碱、盐的性质判断物质间反应时是否有气体生成或气体参加反应.

练习册系列答案
相关题目
10.将硫酸氢钠溶液滴入盛有锌粒的试管中,可以观察到锌粒表面有气泡产生,该反应的化学方程式为:Zn+2NaHSO4=ZnSO4+Na2SO4+H2↑,某同学就该实验的现象及反应化学方程式,得出以下结论,其中正确的是( )
| A. | 单质跟化合物反应生成新的单质和新的化合物的反应一定是置换反应 | |
| B. | 硫酸氢钠电离时产生的阳离子含氢离子,故硫酸氢钠溶液呈酸性 | |
| C. | 上述反应中,金属锌变成锌离子进入溶液,实际上是金属得到了电子 | |
| D. | 硫酸氢钠与金属锌反应后的产物是盐和氢气,符合酸的共性,硫酸氢钠属于酸类 |
11.下列物质中,含有氧分子的是( )
| A. | NO2 | B. | O2 | C. | H2O2 | D. | MnO2 |
15.图象能直观地反映某些科学规律,下列图象正确的是( )
| A. | 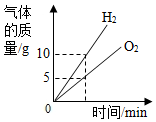 电解水得到H2与O2质量关系 | |
| B. | 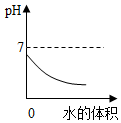 向稀盐酸中加水,溶液的pH变化 | |
| C. |  向NaOH和Na2CO3混合溶液中逐滴滴加稀盐酸 | |
| D. | 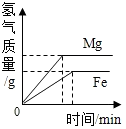 等质量的Mg和Fe与足量相同浓度的稀盐酸反应 |
 钢铁、铝合金、铜制品等是应用广泛的金属材料.据估计,每年全世界被腐蚀损耗的钢铁材料,约占全年钢产量的十分之一.某校化学兴趣小组的同学探究金属腐蚀的原因,设计如下实验:
钢铁、铝合金、铜制品等是应用广泛的金属材料.据估计,每年全世界被腐蚀损耗的钢铁材料,约占全年钢产量的十分之一.某校化学兴趣小组的同学探究金属腐蚀的原因,设计如下实验: 小红同学依据物质类别和物质中某种元素的化合价回忆了教材中常见的一些物质,并构建了部分物质间的转化关系坐标图,如图所示(图中“→”表示物质间的转化).已知A,B,C,D含有一种相同的元素(所有有机物都具有该元素),E,F,D含有两种相同的元素,E与H反应生成F且放出大量的热.F常用于建筑行业.请回答:
小红同学依据物质类别和物质中某种元素的化合价回忆了教材中常见的一些物质,并构建了部分物质间的转化关系坐标图,如图所示(图中“→”表示物质间的转化).已知A,B,C,D含有一种相同的元素(所有有机物都具有该元素),E,F,D含有两种相同的元素,E与H反应生成F且放出大量的热.F常用于建筑行业.请回答:
