题目内容
7.氯化镁是制取镁的原料之一,现要测定某化工产品(含MgCl2和KCl)中所含的氯化镁质量分数,进行实验:先将10g样品完全溶于水,然后把50g一定质量分数的氢氧化钾溶液平均分五次加入样品溶液中,充分振荡,实验所得数据如表:| 编号 | 1 | 2 | 3 | 4 | 5 |
| 加入氢氧化钾溶液的质量/g | 10 | 10 | 10 | 10 | 10 |
| 生成沉淀的质量/g | 0.58 | a | 1.74 | 2.32 | 2.32 |
(1)表中a为1.16.
(2)样品中的氯化钾属于化肥中的钾肥,可回收利用.
(3)计算样品中氯化镁的质量分数是多少?(写出计算过程)
分析 氯化镁和氢氧化钾反应生成氢氧化镁沉淀和氯化钾,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
解答 解:(1)由表中1、2、3、4中的数据可知,每10g氢氧化钾溶液和氯化镁反应生成0.58g氢氧化镁沉淀,20g氢氧化钾溶液和氯化镁反应生成1.16g氢氧化镁沉淀,因此表中a=1.16.
故填:1.16.
(2)样品中的氯化钾含有钾元素,属于化肥中的钾肥,可回收利用.
故填:钾.
(3)设样品中氯化镁质量为x,
MgCl2+2KOH═Mg(OH)2↓+2KCl,
95 58
x 2.32g
$\frac{95}{x}$=$\frac{58}{2.32g}$,
x=3.8g,
样品中氯化镁的质量分数是:$\frac{3.8g}{10g}$×100%=38%,
答:样品中氯化镁的质量分数是38%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
4.二氧化氯是自来水消毒剂,如图为制取二氧化氯的化学反应模型,下列说法正确的是( )
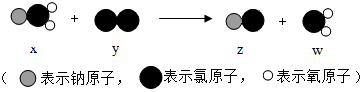

| A. | x、y、z、w均为化合物 | B. | 该反应属于复分解反应 | ||
| C. | 氯元素在物质y中显-1价 | D. | 化学反应前后原子的种类不变 |
18.下列各组变化中,每一转化在一定条件下均能一步实现的是( )

| A. | ①③ | B. | ②③ | C. | ①② | D. | ①②③ |
2.某氮的氧化物中,氮元素与氧元素的质量比为7:16,则该氧化物中氮元素的化合价( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
12.4个坐标图分别表示4个实验过程中某些量的变化,其中正确的是( )
| A. |  在一定温蒂下,向不饱和的硝酸钾溶液中加入硝酸钾固体 | |
| B. |  向氢氧化钠溶液中加入一定量的水 | |
| C. |  高温加热碳酸钙固体至质量不再减轻 | |
| D. |  向含有少量盐酸的氯化铜混合溶液中加入过量的氢氧化钠溶液 向含有少量盐酸的氯化铜混合溶液中加入过量的氢氧化钠溶液 |
19.“绿色生活”是一种能源、环保的生活理念,下列行为中符合该理念的是( )
| A. | 随意丢弃旧电池 | B. | 大量燃放烟花爆竹 | ||
| C. | 将实验后的废液直接倒入水池中 | D. | 尽量选择公共交通工具出行 |
