题目内容
14.将铁粉和铜粉的混合物7g,加入到盛有58.1g稀盐酸的烧杯中,恰好完全反应.此时烧杯内各物质的总质量为64.9g.试计算:(计算结果精确到0.1)反应后所得溶液中溶质的质量分数.
分析 铁与稀盐酸反应生成氯化亚铁和氢气,铜与稀盐酸不反应,根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应铁的质量、生成的氯化亚铁的质量,进而计算出反应后所得溶液中溶质的质量分数.
解答 解:由质量守恒定律,生成氢气的质量为7g+58.1g-64.9g=0.2g.
设参加反应铁的质量为x,生成的氯化亚铁的质量为y
Fe+2HCl═FeCl2+H2↑
56 127 2
x y 0.2g
$\frac{56}{2}=\frac{x}{0.2g}$ x=5.6g
$\frac{127}{2}=\frac{y}{0.2g}$ y=12.7g
反应后所得溶液中溶质的质量分数为$\frac{12.7g}{5.6g+58.1g-0.2g}$×100%=20%.
答:反应后所得溶液中溶质的质量分数为20%.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
5.只用一种试剂来鉴别氢氧化钠、氢氧化钙、稀硫酸三种溶液,这种试剂是( )
| A. | 酚酞试液 | B. | 石蕊试液 | C. | 碳酸钠溶液 | D. | 一氧化碳 |
2.下列有关物质除杂、分离、区分所有的试剂或方法正确的是( )
| 选项 | 实验目的 | 所用试剂或方法 |
| A | 除去NaCl溶液中少量Na2CO3 | 适量澄清石灰水、过滤 |
| B | 判断久置于空气中的熟石灰有无完全变质 | 水或稀盐酸 |
| C | 从KClO3和MnO2制氧气的残余物中分离出MnO2 | 加水溶解、过滤、洗涤、干燥 |
| D | 区分失去标签的稀盐酸和稀硫酸 | 紫色石蕊溶液或铁粉 |
| A. | A | B. | B | C. | C | D. | D |
9.下列物质露制于空气中,一段时间后,质量减小的是( )
| A. | 碳酸钙 | B. | 浓盐酸 | C. | 氯化钠 | D. | 氢氧化钠 |
19.为减少温室气体的排放,人们积极寻找不含碳元素的燃料.经研究发现NH3燃烧的产物没有污染,且释放大量能量,有一定应用前景.其微观过程如图所示:下列说法不正确的是( )
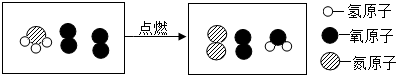

| A. | 该反应前的反应物中氮元素的化合价为-3价 | |
| B. | 该反应前后,分子的种类一定发生变化 | |
| C. | 该反应中参加反应的两种物质的质量比为17:23 | |
| D. | 该反应属于置换反应 |
6. 春暖花开、气候宜人.同学们相约外出踏青野炊.请用化学知识分析下列问题:
春暖花开、气候宜人.同学们相约外出踏青野炊.请用化学知识分析下列问题:
(1)如图是同学们出行使用的交通工具-自行车:
所标各部件中,钛合金车架属于金属材料(从“无机非金属”“金属”“有机合成”“复合”中选填).
食谱如表所示:
从合理膳食角度来看,你认为食谱中还应添加③(填序号);
①豆腐汤 ②牛奶 ③西红柿 ④米饭
(3)小彬用洗洁精清洗了铁锅上的油渍,这是利用了洗洁精的乳化作用,接着他又采用了擦拭干净,然后涂一层植物油的方法防止刚用清水冲洗过的铁锅生锈.
 春暖花开、气候宜人.同学们相约外出踏青野炊.请用化学知识分析下列问题:
春暖花开、气候宜人.同学们相约外出踏青野炊.请用化学知识分析下列问题:(1)如图是同学们出行使用的交通工具-自行车:
所标各部件中,钛合金车架属于金属材料(从“无机非金属”“金属”“有机合成”“复合”中选填).
食谱如表所示:
| 主食 | 馒头、玉米粥 |
| 配菜 | 红烧肉、炒鸡蛋、 炸花生米 |
①豆腐汤 ②牛奶 ③西红柿 ④米饭
(3)小彬用洗洁精清洗了铁锅上的油渍,这是利用了洗洁精的乳化作用,接着他又采用了擦拭干净,然后涂一层植物油的方法防止刚用清水冲洗过的铁锅生锈.
12.下列探究活动没有采用控制变量法的是( )
| A. | 探究水的组成 | B. | 探究影响电阻大小的因素 | ||
| C. | 探究铁制品锈蚀的条件 | D. | 探究影响压力作用效果的因素 |
