题目内容
1.人类的生产生活离不开金属材料,随着科技水平的不断提高,金属及其合金在日常生活中扮演着越来越重要的角色.(1)铁锅、铝锅是生活中常用的炊具,如图1是铁锅的示意图.

①用铁锅烹饪食物是利用金属的导热性质;
②铁锅含有的金属材料是铸铁(填写名称).
(2)铝的活动性比铁强,但铝在空气中却表现出良好的抗腐蚀性能,其原因是铝与氧气反应表面生成致密的氧化铝薄膜,阻止铝的进一步氧化.
(3)汽车使用天然气作燃料,排放污染较低.天然气的主要成分为甲烷.随着全球能源使用量的增长,人类正在开发新能源,如潮汐能、核能、太阳能(填一种即可)等.
(4)硬币制造涉及到得金属有:Fe、Cu、Al、Ni(镍)等.已知Ni能够发生如下反应:Ni+H2SO4=NiSO4+H2↑ Fe+NiCl2=FeCl2+Ni这两个反应都属于基本反应类型中的置换反应.Fe、Cu、Al、Ni的活动性由强到弱的顺序是Al>Fe>Ni>Cu(用元素符号表示)
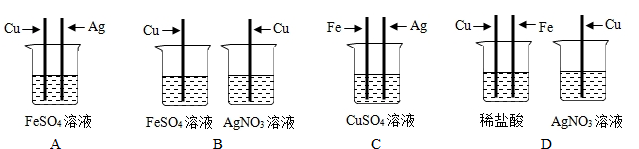
(5)为探究Fe、Cu、Ag三种金属的活动性顺序,某兴趣小组设计了如图2所示的四组实验方案,你认为不可行的是A.
分析 (1)铁锅利用了金属的导热性良好;金属材料包括纯金属和合金;
(2)根据铝易与氧气反应生成致密的氧化铝薄膜,进行分析回答.
(3)天然气的主要成分是甲烷;人类正在开发新能源,如潮汐能、核能、太阳能、风能等;
(4)在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来;
(5)根据金属活动顺序进行思考,Fe、Cu、Ag这三种金属的金属活动性由强到弱的顺序为Fe>Cu>Ag.在金属活动顺序表中,前边的金属可以把后边的金属从其盐溶液中置换出来,所以可以根据相应的金属和盐溶液进行反应来证明这三种金属的活动性强弱.
解答 解:(1)铁锅利用了金属的导热性良好;铸铁属于金属材料.
(2)常温下,铝与氧气反应表面生成致密的氧化铝薄膜,阻止铝的进一步氧化,因此铝锅比较耐用;
(3)天然气的主要成分是甲烷;人类正在开发新能源,如潮汐能、核能、太阳能、风能等.
(4)Ni+H2SO4═NiSO4+H2↑,说明Ni的活动性强于H,Fe+NiCl2═FeCl2+Ni说明Fe的活动性强于Ni,故Fe、Cu、Al、Ni的活动性由强到弱的顺序是Al>Fe>Ni>Cu,这两个反应都属于基本反应类型中的置换反应,故填:置换反应,Al>Fe>Ni>Cu;
(5)A、把铜和银同时放入盛硫酸亚铁的烧杯中,都不发生反应,只能证明铁的活动性最强,而铜和银探究不出来,故A正确.
B、把铜分别放入硫酸亚铁溶液和硝酸银溶液中,铜不与硫酸亚铁溶液反应,能和硝酸银溶液反应,因此能证明三种金属的活动性强弱,故B错误.
C、把铁和银放入硫酸铜溶液中,铁表面有红色物质析出,银与硫酸铜不反应,证明铁的活动性比铜强,铜的活动性比银强,故C错误.
D、把铜和铁放入稀盐酸中,铁表面有气泡冒出,铜表面没现象,证明铁比氢活动性强,铜比氢活动性弱,把铜放入硝酸银溶液中,铜表面有白色物质析出,证明铜比银强,能证明三种金属的活动性,故D错误.
故选A.
故答案为:(1)导热;铸铁;(2)铝与氧气反应表面生成致密的氧化铝薄膜,阻止铝的进一步氧化(3)甲烷;太阳能、风能等(其他答案合理给分).
(4)置换反应,Al>Fe>Ni>Cu;(5)A.
点评 化学来源于生产、生活,也服务于生产、生活,与生产、生活相关的化学知识,关乎我们的生存、健康和社会的发展,是中考热点之一.

 阅读快车系列答案
阅读快车系列答案| A. | 铁丝在氧气中剧烈燃烧时火星四射,放出大量热,产生四氧化三铁 | |
| B. | 向滴有紫色石蕊的水中吹气,紫色石蕊变蓝色 | |
| C. | 向无水硫酸铜粉末中滴加少量水,粉末由蓝色变白色 | |
| D. | 向澄清石灰水中通入二氧化碳,溶液变浑浊 |
 如图是镁和氯两种元素的有关信息,则下列说法错误的是( )
如图是镁和氯两种元素的有关信息,则下列说法错误的是( )| A. | 镁原子结构图中X=8 | B. | 镁和氯组成化合物的化学式为MgCl | ||
| C. | 镁是金属元素、氯是非金属元素 | D. | 氯元素的原子序数为17 |
| A. | 火碱 纯碱 汞 | B. | 石油 煤 天然气 | ||
| C. | 冰水共存物 干冰 氮气 | D. | 洁净的空气 氯化氢 液氧 |
材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(如表是其片断),并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素.
| 13 Al 铝 26.98 | 14 Si 硅 28.09 |
| 类铝 | 类硅 |
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g•cm-3,从而验证了元素周期表的正确性.随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素.目前金属镓广泛用于制造半导体材料.镓的原子结构示意图如图
 ,常见化合价为+3.
,常见化合价为+3.根据你的理解回答下列问题:
(1)镓元素原子的质子数为31,其原子最外层电子数为3;
(2)请根据上述材料,总结金属镓的有关知识:
物理性质:银白色金属,密度为5.94g•cm-3;
化学性质(请用化学方程式表示):2Ga+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Ga(OH)3+3H2↑;
用途:制造半导体材料;
(3)氢氧化镓与氢氧化钠都具有碱的性质,则氢氧化镓与稀硫酸反应生成盐的化学式为_Ga2(SO4)3.
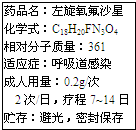 新药左旋氧氟沙星(C3H8FN2O4)可用于治疗敏感菌引起的呼吸道感染,其说明书中部分内容如图.
新药左旋氧氟沙星(C3H8FN2O4)可用于治疗敏感菌引起的呼吸道感染,其说明书中部分内容如图. 我们的衣食住行与化学知识密不可分.请根据下列生活中的事实填空.
我们的衣食住行与化学知识密不可分.请根据下列生活中的事实填空.