题目内容
5.下列四个图象中,能正确表示对应变化关系的是( ) |  | 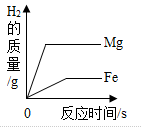 | 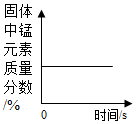 |
| A、向一定量稀盐 酸中加水稀释 | B、向硫酸和硫酸铜的混合稀溶液中,逐滴加入氢氧化钠溶液 | C、足量的镁片和铁片分别与等质量、等质量分数稀盐酸反应 | D、加热一定量的 高锰酸钾固体 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、根据向一定量的稀盐酸中加水稀释时溶液不可能显中性或碱性进行解答;
B、根据向硫酸和硫酸铜的混合稀溶液中,逐滴加入氢氧化钠溶液,氢氧化钠会先于硫酸反应,然后硫酸铜再与氢氧化钠反应进行分析;
C、根据金属是足量的,所以盐酸全部反应,生成的氢气质量相等进行分析;
D、根据高锰酸钾在解加热的条件下生成锰酸钾、二氧化锰和氧气进行分析.
解答 解:A、向一定量的稀盐酸中加水稀释时溶液不可能显中性或碱性,溶液的pH值不可能等于或大于7,故A错误;
B、向硫酸和硫酸铜的混合稀溶液中,逐滴加入氢氧化钠溶液,氢氧化钠会先于硫酸反应,然后硫酸铜再与氢氧化钠反应,所以不会立即出现沉淀,故B正确;
C、金属是足量的,所以盐酸全部反应,生成的氢气质量相等,故错误;
D、高锰酸钾在解加热的条件下生成锰酸钾、二氧化锰和氧气,固体质量减少,锰元素的质量不变,所以固体中锰元素的质量分数逐渐增大,然后不变,故D错误.
故选:B.
点评 该题为图象题,这样的题型往往每个选项考查不同的知识点,或化学反应或溶液组成等,多数考查物质(沉淀、气体)质量、质量分数的变化,在解题时对每个选项认真分析,找准考查的知识点,结合对应的知识迁移解答.

练习册系列答案
相关题目
2.“过氧化钠(Na2O2)”是一种淡黄色固体,能与水或二氧化碳反应放出氧气.实验室有一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分及其质量.
【提出问题】变质的过氧化钠粉末中有哪些成分,它们的质量是多少?
【查阅资料】
①2Na2O2+2H2O═4NaOH+O2↑ 2Na2O2+2CO2═2Na2CO3+O2
②碳酸钠溶液显碱性,氯化钙溶液显中性.
【猜想与假设】
(1)粉末成分是Na2O2和NaOH的混合物
(2)粉末成分是Na2O2和Na2CO3的混合物
(3)粉末成分是Na2O2、NaOH 和Na2CO3的混合物
…
【设计实施方案】
【解释与结论】同学们经过认真分析,得出了以下结论.
粉末中含有的成分及质量
【反思与评价】
(1)实验室在保存过氧化钠时应注意密封保存.
(2)有同学提出把第②步实验中足量的石灰水改为足量氯化钙溶液,至沉淀不再生成时过滤,向滤液中滴加无色酚酞试液,若液体变红,则证明原粉末中有NaOH.你认为该方案是否合理并说明理由不合理,因为过氧化钠与水反应能生成氢氧化钠,不能判断原来是否存在氢氧化钠..
【提出问题】变质的过氧化钠粉末中有哪些成分,它们的质量是多少?
【查阅资料】
①2Na2O2+2H2O═4NaOH+O2↑ 2Na2O2+2CO2═2Na2CO3+O2
②碳酸钠溶液显碱性,氯化钙溶液显中性.
【猜想与假设】
(1)粉末成分是Na2O2和NaOH的混合物
(2)粉末成分是Na2O2和Na2CO3的混合物
(3)粉末成分是Na2O2、NaOH 和Na2CO3的混合物
…
【设计实施方案】
| 实验步骤 | 实验现象 |
| ①取3.00g变质粉末于一支大试管内,加入适量的水,共收集到0.32g气体,然后用带火星木条检验生成的气体. | 固体完全溶解,带火星木条复燃, 不用填 |
| ②继续向上述试管中加入足量的石灰水,充分反应. | 有白色沉淀生成 |
| ③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体1.00g. |
粉末中含有的成分及质量
| Na2O2 | NaOH | Na2CO3 | |
| 成分(填“有”或“没有”) | |||
| 质量(g) |
(1)实验室在保存过氧化钠时应注意密封保存.
(2)有同学提出把第②步实验中足量的石灰水改为足量氯化钙溶液,至沉淀不再生成时过滤,向滤液中滴加无色酚酞试液,若液体变红,则证明原粉末中有NaOH.你认为该方案是否合理并说明理由不合理,因为过氧化钠与水反应能生成氢氧化钠,不能判断原来是否存在氢氧化钠..
9.下列关于氧气的说法错误的是( )
| A. | 氧气的体积约占空气体积的21% | |
| B. | 空气中氧气主要来自植物的光合作用 | |
| C. | 利用氧炔焰割断金属,说明氧气具有可燃性 | |
| D. | 工业上可用分离空气法制氧气 |
6.我们的生活离不开水,水是一种( )
①纯净物②氧化物③单质④化合物⑤混合物.
①纯净物②氧化物③单质④化合物⑤混合物.
| A. | ①② | B. | ②④ | C. | ①②④ | D. | ⑤ |
 ”和“
”和“ ”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下:
”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下:

 如图所示是a、b、c三种固体物质的溶解度曲线,请根据图示回答:
如图所示是a、b、c三种固体物质的溶解度曲线,请根据图示回答: