题目内容
12.某金属冶炼厂的管道烟泥中含有炭黑及金属铜、锌、硫.综合实践活动小组的同学设计了从管道烟泥中回收金属铜并利用废气中的二氧化硫制备硫酸的实验方案,实验过程如图所示:
请回答:
(1)步骤①中,过滤操作使用了玻璃棒,其作用是引流.
(2)步骤④中,所加入的金属X与Zn的活动性顺序是Zn>X,金属X具有广泛用途,X是铁,有关反应的化学方程式Fe+CuSO4═FeSO4+Cu.
(3)除去不纯铜中的杂质金属X,可选用的试剂或用品有abd(填字母序号).
a.磁铁 b.稀盐酸 c.蒸馏水 d.氯化铜溶液.
(4)将分离出的SO2通过下列碘循环工艺过程既能制H2SO4,又能制取H2,其流程如下:

试写出反应器、膜反应器中的化学反应方程式SO2+2H2O+I2$\frac{\underline{\;20~100℃\;}}{\;}$H2SO4+2HI、2HI$\frac{\underline{\;500℃\;}}{\;}$I2+H2↑.
分析 (1)玻璃棒的用途有引流、搅拌、转移物质等;
(2)铁不如锌活泼,具有广泛用途,比铜活泼,能和硫酸铜反应生成硫酸亚铁和铜;
(3)磁铁能够吸引铁,稀盐酸能和铁反应生成氯化亚铁和氢气,氯化铜能和铁反应生成氯化亚铁和铜;
(4)20~100℃时,二氧化硫能和水、碘反应生成硫酸和碘化氢;
500℃时,碘化氢分解生成碘和氢气.
解答 解:(1)步骤①中,过滤操作使用了玻璃棒,其作用是引流.
故填:引流.
(2)步骤④中,所加入的金属X与Zn的活动性顺序是Zn>X,金属X具有广泛用途,X是铁,铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
故填:铁;Fe+CuSO4═FeSO4+Cu.
(3)除去不纯铜中的杂质金属铁,可选用磁铁,因为磁铁能够把铁从混合物中吸引出来,也可以用稀盐酸,因为铜不能和稀盐酸反应,铁能和稀盐酸反应生成氯化亚铁和氢气,过滤可以得到铜,也可以用氯化铜溶液,因为铁能和氯化铜反应生成氯化亚铁和铜,过滤可以得到铜,不能用蒸馏水,因为铜和铁都不溶于蒸馏水.
故填:abd.
(4)20~100℃时,二氧化硫能和水、碘反应生成硫酸和碘化氢,反应的化学方程式为:
SO2+2H2O+I2$\frac{\underline{\;20~100℃\;}}{\;}$H2SO4+2HI;
500℃时,碘化氢分解生成碘和氢气,反应的化学方程式为:2HI$\frac{\underline{\;500℃\;}}{\;}$I2+H2↑.
故填:SO2+2H2O+I2$\frac{\underline{\;20~100℃\;}}{\;}$H2SO4+2HI;2HI$\frac{\underline{\;500℃\;}}{\;}$I2+H2↑.
点评 碘化氢的水溶液又称为氢碘酸,氢碘酸受热分解生成碘和氢气,氢碘酸是液体,因此生成的氢气的化学式后面应该加上“↑”.

| A. | 单质 | B. | 原子 | C. | 分子 | D. | 元素 |
| A. | Mg和MgCO3 | B. | CaO和CaCO3 | C. | CaO和Ca(OH)2 | D. | Mg和MgO |
 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.老师提示:
I.电解饱和食盐水的化学方程式:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对本实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 取样,滴加几滴无色酚酞试液 | 溶液变红色 | 待测液中含有氢氧化钠. |
【实验】用沉淀法测定
资料摘要:氢氧化钠与氯化镁在溶液中发生反应:
同学们按如图所示的实验步骤进行实验:
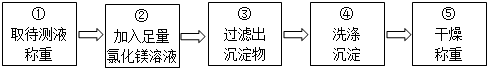
(2)步骤②加入的氯化镁溶液必需足量,其目的是使NaOH完全反应.步骤④中判断沉淀物是否洗净的具有操作:取最后一次洗涤液少许于试管中,滴加硝酸银溶液,若无白色沉淀生成,说明沉淀物已洗净,反之则没有洗净(写出实验步骤、现象和结论).
(3)步骤②中发生反应的化学方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
(4)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
| A. | Na2SO4、NaOH、KCl | B. | CuSO4、CaCl2、AgNO3 | ||
| C. | C、Na2CO3、KCl、NaCl | D. | KNO3、NaCl、Mg(NO3)2 |

 向微型实验仪器井穴板的4个井穴(己编号)中分别滴加①稀硫酸②碳酸钾③硫酸铝④硝酸银四种溶液各3滴,再各加1 滴紫色石蕊试液(所有试剂用量共约0-8mL).观察到①③④井穴中溶液 变红,②井穴中溶液变蓝,由本实验得出的以下结论中正确的是( )
向微型实验仪器井穴板的4个井穴(己编号)中分别滴加①稀硫酸②碳酸钾③硫酸铝④硝酸银四种溶液各3滴,再各加1 滴紫色石蕊试液(所有试剂用量共约0-8mL).观察到①③④井穴中溶液 变红,②井穴中溶液变蓝,由本实验得出的以下结论中正确的是( )