题目内容
5. “双吸剂”是常用的袋装食品的保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体.某化学小组的同学在袋装食品中发现一包名为“504双吸剂”的保鲜剂,其标签如图14所示.同学们对这包久置的“504双吸剂”的固体样品很好奇,展开了实验探究.请你一起参与探究活动,并填写题中空白.
“双吸剂”是常用的袋装食品的保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体.某化学小组的同学在袋装食品中发现一包名为“504双吸剂”的保鲜剂,其标签如图14所示.同学们对这包久置的“504双吸剂”的固体样品很好奇,展开了实验探究.请你一起参与探究活动,并填写题中空白.【提出问题】久置“双吸剂”的成分是什么?
【做出猜想】久置“双吸剂”中可能有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3
【实验探究1】取固体样品研磨,用磁铁吸引,磁铁上沾有黑色粉末,说明“双吸剂”中一定有Fe.再用磁铁反复吸引后,残留固体用于后续探究活动.
【实验探究2】
| 实验操作 | 实验现象 | 实验结论 |
| 1.将实验探究1中残留固体中加入足量水充分溶解 | 固体部分溶解,并放出热量 | 固体中一定含有CaO; |
| 2.过滤,向滤液中滴加几滴无色酚酞试液 | 无色变红色 | 固体中一定含有Ca(OH)2 |
| 3.取过滤后滤渣,加入足量稀盐酸 | 1.产生大量气泡 2.溶液由无色变为黄色 | 固体中一定有CaCO3和 Fe2O3. |
(1)请写出【探究2】操作3中所涉及的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑,3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)有同学提出【探究2】操作2中得出的结论不合理,理由是CaO+H2O=Ca(OH)2.(用方程式表示)
分析 本题能使同学们体会到实验探究的一般过程,通过实验分析可知:取固体样品研磨,用磁铁吸引,磁铁上沾有黑色粉末,说明“双吸剂”中一定有铁粉,因为磁铁能吸引铁粉;将实验探究1中残留固体中加入足量水充分溶解,固体部分溶解,并放出热量,固体中一定含有氧化钙,因为氧化钙与水反应放出热量;过滤,向滤液中滴加几滴无色酚酞试液,无色变红色,固体中一定含有Ca(OH)2;取过滤后滤渣,加入足量稀盐酸,产生大量气泡,溶液由无色变为黄色,固体中一定有CaCO3和Fe2O3,因为碳酸钙与盐酸反应冒出二氧化碳气体,氧化铁与盐酸反应生成氯化铁和水,溶液由无色变黄色;【探究2】操作2中得出的结论不合理,理由是:氧化钙与水反应生成氢氧化钙,因此向滤液中滴加几滴无色酚酞试液,无色变红色,固体中不一定有氢氧化钙,生成的氢氧化钙也会是无色酚酞试液变红色;有关化学方程式的书写要配平.
解答 解:(1)【实验探究1】通过实验分析可知:取固体样品研磨,用磁铁吸引,磁铁上沾有黑色粉末,说明“双吸剂”中一定有铁粉,因为磁铁能吸引铁粉;故答案为:Fe;
(2)【实验探究2】将实验探究1中残留固体中加入足量水充分溶解,固体部分溶解,并放出热量,固体中一定含有氧化钙,因为氧化钙与水反应放出热量;过滤,向滤液中滴加几滴无色酚酞试液,无色变红色,固体中一定含有Ca(OH)2;取过滤后滤渣,加入足量稀盐酸,产生大量气泡,溶液由无色变为黄色,固体中一定有CaCO3和Fe2O3,因为碳酸钙与盐酸反应冒出二氧化碳气体,氧化铁与盐酸反应生成氯化铁和水,溶液由无色变黄色;故答案为:CaO;无色变红色;CaCO3;Fe2O3;
(3)【反思提高】碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,配平即可;【探究2】操作2中得出的结论不合理,理由是:氧化钙与水反应生成氢氧化钙,因此向滤液中滴加几滴无色酚酞试液,无色变红色,固体中不一定有氢氧化钙,生成的氢氧化钙也会是无色酚酞试液变红色;故答案为:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;(2)CaO+H2O=Ca(OH)2;
点评 本考点既考查了实验步骤的设计,又考查了化学方程式的书写,还对实验进行了评价,综合性比较强.实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究.同学们要具体分析,综合掌握.

 一线名师权威作业本系列答案
一线名师权威作业本系列答案 如图所示,一物体悬挂在饱和氯化钠溶液中,要使弹簧秤读数保持不变,在恒温条件下,可向烧杯内的溶液中加入(悬挂物不参与反应)( )
如图所示,一物体悬挂在饱和氯化钠溶液中,要使弹簧秤读数保持不变,在恒温条件下,可向烧杯内的溶液中加入(悬挂物不参与反应)( )| A. | 同温度下的饱和氯化钠溶液 | B. | 水 | ||
| C. | 硝酸钾晶体 | D. | 氯化钠晶体 |
| A. | 阳光为火种的燃烧提供了热量,使其达到着火点 | |
| B. | 火炬燃烧时,化学能转化为热能和光能 | |
| C. | 强风和大雨下火炬仍可以保持燃烧,是因为火炬燃料的燃烧不受燃烧的条件影响 | |
| D. | 火炬内装的燃料丙烷(C3H8)由两种元素组成 |
| A. | NH3 | B. | CO2 | C. | H2 | D. | SO2 |
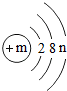 某粒子(原子或离子)的结构示意图为,请回答下列问题:
某粒子(原子或离子)的结构示意图为,请回答下列问题:


