题目内容
16.加热24.5克氯酸钾和含少量二氧化锰的混合物,当质量减少了9.6克时,停止加热、则反应剩余物中含有的是( )| A. | KClO3、KCl | B. | KCl、KClO3、MnO2 | C. | KCl | D. | KCl、MnO2 |
分析 根据氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,固体减少的质量就是氧气的质量,然后依据化学方程式进行计算.
解答 解:设需要氯酸钾的质量为x,生成氯化钾的质量为y,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 149 96
x y 9.6g
$\frac{245}{x}$=$\frac{149}{y}$=$\frac{96}{9.6g}$
x=24.5g
y=14.9g
所以剩余固体为氯化钾和二氧化锰,故选:D.
点评 本考点考查了根据化学方程式的计算,是比较基础的计算题,属于已知生成物的质量,求反应物的质量.

练习册系列答案
相关题目
7.建立宏观与微观的联系是化学独特的思维方式,下列对宏观现象的微观解释不正确的是( )
| A. | 水和过氧化氢的化学性质不同,是因为这两种物质的分子构成不同 | |
| B. | CO2使紫色石蕊试液变红,是因为CO2分子能与紫色石蕊发生化学反应 | |
| C. | 哇哈哈富氧水能够补氧,是因为富氧水里溶有氧气分子 | |
| D. | 高山上喝空的矿泉水瓶,抒紧瓶盖,下山后瓶子变瘪,是因为瓶内的气体分子变小 |
4.毕倭寇同学想通过实验,探究某企业用氨碱法生产纯碱样品的成分及含量.
【提出问题】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,毕倭寇同学做出如下假设:(1)只含有Na2CO3;(2)含有Na2CO3和 NaHCO3【查阅资料】
(1)表中的现象I为产生气泡;
(2)现象Ⅱ对应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【实验探究】为了确定纯碱样品的成分,毕倭寇同学设计如下实验方案,请你一起完成下列实验报告.
【实验反思】实验步骤A中,氯化钙溶液过量的目的是将碳酸钠全部除去.
【提出问题2】如何测量该纯碱样品中各物质的含量?
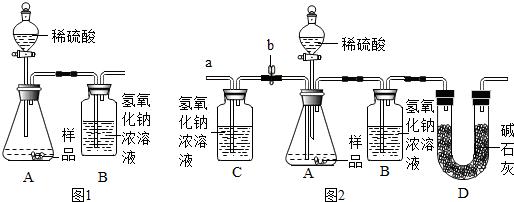
(1)为测量该纯碱样品各成分的含量,毕倭寇同学设了图1装置,通过称量B装置中质量变化来确定样品中各成分的含量.该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误,但多次实验发现,测定结果有偏差.造成偏差的原因有①空气中的CO2进入装置B被氢氧化钠吸收;②装置A中残留的CO2未被装置B中的氢氧化钠吸收.
(2)毕倭寇同学在老师的指导下重新设计了如图2所示的实验装置.该实验有以下操作步骤:
①查装置气密性,将Wg干燥的样品放入锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量.
该实验的正确步骤是①③②④⑥⑤⑦.
【提出问题】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,毕倭寇同学做出如下假设:(1)只含有Na2CO3;(2)含有Na2CO3和 NaHCO3【查阅资料】
| NaHCO3 | Na2CO3 | |
| 加入稀盐酸 | 现象I | 产生气泡 |
| 加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(2)现象Ⅱ对应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【实验探究】为了确定纯碱样品的成分,毕倭寇同学设计如下实验方案,请你一起完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论及化学方程式 |
| A取少量样品溶于水,加入过量的CaCl2溶液 | ①有白色沉淀产生 | 该反应的方程式:②Na2CO3+CaCl2═CaCO3↓+2NaCl |
| B将上述反应后的混合液过滤,取滤液③滴加稀盐酸 | ④有气泡冒出 | 证明猜想②成立 |

【实验反思】实验步骤A中,氯化钙溶液过量的目的是将碳酸钠全部除去.
【提出问题2】如何测量该纯碱样品中各物质的含量?
(1)为测量该纯碱样品各成分的含量,毕倭寇同学设了图1装置,通过称量B装置中质量变化来确定样品中各成分的含量.该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误,但多次实验发现,测定结果有偏差.造成偏差的原因有①空气中的CO2进入装置B被氢氧化钠吸收;②装置A中残留的CO2未被装置B中的氢氧化钠吸收.
(2)毕倭寇同学在老师的指导下重新设计了如图2所示的实验装置.该实验有以下操作步骤:
①查装置气密性,将Wg干燥的样品放入锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量.
该实验的正确步骤是①③②④⑥⑤⑦.
11.如图所示的实验操作正确的是( )
| A. |  实验室制取二氧化碳 | B. |  盖灭酒精灯 | ||
| C. |  实验室制取氧气 | D. |  过滤 |
5.对比分析CO和CO2得出下列结论,错误的是( )
| A. | 都属于氧化物 | B. | 组成元素种类相同 | ||
| C. | 化学性质不同 | D. | 构成分子的原子种类不同 |
