题目内容
5.对比分析CO和CO2得出下列结论,错误的是( )| A. | 都属于氧化物 | B. | 组成元素种类相同 | ||
| C. | 化学性质不同 | D. | 构成分子的原子种类不同 |
分析 根据CO和CO2的构成和性质分析判断有关的说法.
解答 解:A、CO和CO2都是由两种元素组成且其中一种是氧元素的化合物,属于氧化物,故A说法正确;
B、CO和CO2的都由碳、氧元素组成,组成元素种类相同,故B说法正确;
C、CO具有可燃性、还原性和毒性,而CO2没有这些性质,化学性质不相同,故C说法正确;
D、CO和CO2的分子都由碳、氧两种原子构成,故D说法不正确.
故选D.
点评 本题的难度不大,了解CO和CO2的组成、性质等知识是解答本题的基础.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
15.如表是某城市某日空气质量报告:
某研究性学习小组对表中首要污染物S02:导致酸雨的成因进行探究.
(提示:S02:是一种无色、有刺激性气味的有毒气体,易溶于水,具有与C02相似的化学性质)
【探究实验】实验一:用如图1所示装置进行实验.
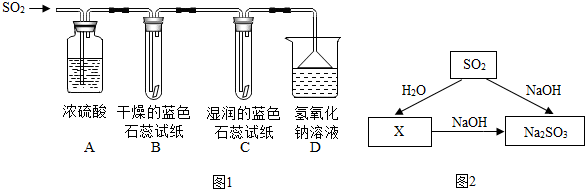
(1)A装置的作用是干燥 SO2气体.
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变红色,说明SO2与水反应生成一种酸.
(3)D装置的作用是吸收SO2,防止污染空气,发生反应的化学方程式是SO2+2NaOH═Na2SO3+H2O.
实验二:往盛有水的烧杯中通人SO2气体,测所得溶液的pH< 7(填“>”“=”或“<”),然后每隔l小时测定其pH,发现pH逐渐变小,直至恒定,说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4.
【查阅资料】SO2形成酸雨的另一途径:S02与空气中的02在飘尘的作用下反应生成SO3
(飘尘的质量和性质在反应前后不发生变化),SO3溶于降水生成H2SO4.在此过程中飘尘作催化剂.
【探究结论】SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
【模拟实验】(1)由于食醋和酸雨的酸度(pH)差不多,
因此酸雨对大理石的作用可以通过大理石碎片放在醋中来模拟.当把2.0g大理石碎片放在醋中一整夜后,取出固体干燥称重,其质量可能是(醋酸钙易溶于水)A.
A.小于2.0gB.正好2.0g C.大于2.0g
(2)这组学生还做了另一个实验,即将大理石碎片放在蒸馏水中过夜,
其实验的目的是作对照,证明对大理石起腐蚀作用的是醋酸而不是水
【知识联想】SO2具有与CO2相似的化学性质,
根据图2给出的SO2及其化合物问的相互转化关系回答:
X的化学式是H2SO3,
写出X与NaOH反应的化学方程H2SO3+2NaOH═Na2SO3+2H2O.
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | S02 | Ⅱ | 良 |
(提示:S02:是一种无色、有刺激性气味的有毒气体,易溶于水,具有与C02相似的化学性质)
【探究实验】实验一:用如图1所示装置进行实验.

(1)A装置的作用是干燥 SO2气体.
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变红色,说明SO2与水反应生成一种酸.
(3)D装置的作用是吸收SO2,防止污染空气,发生反应的化学方程式是SO2+2NaOH═Na2SO3+H2O.
实验二:往盛有水的烧杯中通人SO2气体,测所得溶液的pH< 7(填“>”“=”或“<”),然后每隔l小时测定其pH,发现pH逐渐变小,直至恒定,说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4.
【查阅资料】SO2形成酸雨的另一途径:S02与空气中的02在飘尘的作用下反应生成SO3
(飘尘的质量和性质在反应前后不发生变化),SO3溶于降水生成H2SO4.在此过程中飘尘作催化剂.
【探究结论】SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
【模拟实验】(1)由于食醋和酸雨的酸度(pH)差不多,
因此酸雨对大理石的作用可以通过大理石碎片放在醋中来模拟.当把2.0g大理石碎片放在醋中一整夜后,取出固体干燥称重,其质量可能是(醋酸钙易溶于水)A.
A.小于2.0gB.正好2.0g C.大于2.0g
(2)这组学生还做了另一个实验,即将大理石碎片放在蒸馏水中过夜,
其实验的目的是作对照,证明对大理石起腐蚀作用的是醋酸而不是水
【知识联想】SO2具有与CO2相似的化学性质,
根据图2给出的SO2及其化合物问的相互转化关系回答:
X的化学式是H2SO3,
写出X与NaOH反应的化学方程H2SO3+2NaOH═Na2SO3+2H2O.
16.加热24.5克氯酸钾和含少量二氧化锰的混合物,当质量减少了9.6克时,停止加热、则反应剩余物中含有的是( )
| A. | KClO3、KCl | B. | KCl、KClO3、MnO2 | C. | KCl | D. | KCl、MnO2 |
13.自来水是我国目前主要的生活饮用水,下表是我国颁布的生活饮用水水质标准的部分内容:
(1)感官指标表现的是自来水的物理(填“物理”或“化学”)性质.
(2)自来水中的游离氯有少量可转变为氯离子,氯离子的符号是Cl-.
(3)实验室用自来水制取蒸馏水的方法是D(填序号).
A.吸附 B.沉淀 C.过滤 D.蒸馏.
| 项目 | 标准 |
| 感官指标 | 无异味、异臭等 |
| 化学指标 | pH 6.5-8.5,铜<1.0mg•L-1,铁<0.3mg•L-1, 氟化物<1.0mg•L-1,游离氯≥0.3mg•L-1等 |
(2)自来水中的游离氯有少量可转变为氯离子,氯离子的符号是Cl-.
(3)实验室用自来水制取蒸馏水的方法是D(填序号).
A.吸附 B.沉淀 C.过滤 D.蒸馏.
 如图中A是氯元素在元素周期表中的相关信息,B是氯离子的结构示意图,分析图中提供的信息,回答问题
如图中A是氯元素在元素周期表中的相关信息,B是氯离子的结构示意图,分析图中提供的信息,回答问题