题目内容
5.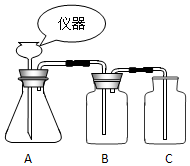 根据如图装置回答下列问题:
根据如图装置回答下列问题:(1)若在锥形瓶中装有碳酸钙,则该装置可以制取的气体是二氧化碳;但是某同学在B中装入氢氧化钠溶液,最后未收集到该气体,原因是(用化学方程式表示)2NaOH+CO2=Na2CO3+H2O.
(2)若用此套装置制取干燥氧气,则锥形瓶中发生反应的化学方程式是2H2O2=2H2O+O2↑;那么B装置应该装入的物质名称是浓硫酸.
分析 (1)用碳酸钙和稀盐酸反应可以产生二氧化碳,氢氧化钠能够吸收二氧化碳;
(2)该装置适合过氧化氢溶液在二氧化锰的作用下制取氧气,浓硫酸具有吸水性,可以干燥氧气.
解答 解:(1)用碳酸钙和稀盐酸反应可以产生二氧化碳,因为氢氧化钠能够吸收二氧化碳,故最后未收集到二氧化碳,反应的方程式为:2NaOH+CO2=Na2CO3+H2O;
(2)该装置适合过氧化氢溶液在二氧化锰的作用下制取氧气,因为浓硫酸具有吸水性,可以干燥氧气,故B装置应该装入的物质名称是浓硫酸.
故答案为:(1)2NaOH+CO2=Na2CO3+H2O;
(2)浓硫酸.
点评 本题是根据装置的特点选择气体的制取、干燥、吸收等问题,难度不大,关键是明确发生装置和收集装置选择的依据.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
15.下图中的符号表示2个氧分子的是( )
| A. |  | B. |  | C. |  | D. |  |
13.碳酸钡广泛应用于显像管、光学玻璃等行业.有一种碳酸盐矿石,其主要成分是碳酸钙和碳酸钡.现有该碳酸盐矿石粉末样品(假设杂质不溶于水,也不与盐酸反应),为检验该样品的主要成分,小明同学做了一个实验:取少量样品于烧杯中,加入过量的稀盐酸.
(1)在小明同学的实验中,可观察到的实验现象是固体部分溶解,产生气泡,该实验的目的是检验样品中含有碳酸盐.
(2)在小明同学实验的基础上,请你设计一个实验方案,以进一步证明该碳酸盐矿石的主要成分是碳酸钙和碳酸钡.(本实验条件下,微溶物不形成沉淀)
(1)在小明同学的实验中,可观察到的实验现象是固体部分溶解,产生气泡,该实验的目的是检验样品中含有碳酸盐.
(2)在小明同学实验的基础上,请你设计一个实验方案,以进一步证明该碳酸盐矿石的主要成分是碳酸钙和碳酸钡.(本实验条件下,微溶物不形成沉淀)
| 实验操作 | 预期现象与结论 |
| 取小明同学实验中的少量滤液于烧杯中,向烧杯中 加入过量的稀硫酸,并用玻璃棒搅拌. | 有白色沉淀生成,说明含有硫酸根离子,证明矿石中含有碳酸钡 |
| 向上述实验中的上层清液加入足量的碳酸钠溶液 | 有白色沉淀生成,说明含有钙离子,证明矿石中含有碳酸钙 |
14.为了对氯化钾样品(含KNO3)进行分析,甲、乙、丙三位同学分别进行实验.他们的实验数据如下表,请仔细观察和分析数据,回答下列问题:
(1)该样品中KCl的质量分数是多少?
(2)三位同学分别把反应后的溶液过滤(操作中的损失可忽略不计),哪一位同学所得的滤液中只含有一种溶质?此溶液的溶质质量分数是多少?
| 项目 | 甲 | 乙 | 丙 |
| 所取固体样品质量(克) | 20 | 10 | 10 |
| 加入AgNO3溶液的质量(克) | 100 | 100 | 200 |
| 反应后所得的沉淀质量(克) | 14.35 | 14.35 | 14.35 |
(2)三位同学分别把反应后的溶液过滤(操作中的损失可忽略不计),哪一位同学所得的滤液中只含有一种溶质?此溶液的溶质质量分数是多少?
15.某物质在氧气中完全燃烧只生成二氧化碳和水.据此判断该物质组成说法正确的是( )
| A. | 只含有碳、氢元素基础 | B. | 含有碳、氢、氧三种元素 | ||
| C. | 含有碳、氢元素,可能含有氧元素 | D. | 无法确定 |
 :
:


