题目内容
5.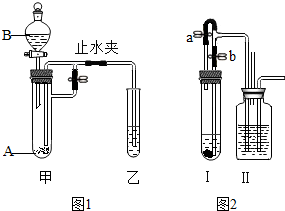 某化学小组同学利用图示装置进行实验(图中固定装置省略),其中装置甲的试管中盛有固体粉末A,分液漏斗中盛有足量溶液B.
某化学小组同学利用图示装置进行实验(图中固定装置省略),其中装置甲的试管中盛有固体粉末A,分液漏斗中盛有足量溶液B.(1)如图1所示:若装置乙中水下有少量白磷,实验时将B滴加到A中后,关闭分液漏斗活塞,打开止水夹,则乙中有气泡冒出,白磷不燃烧;关闭止水夹,则乙中的现象是液面上升,且白磷燃烧.关闭止水夹前后,白磷产生现象差异的原因是液体被压入乙中,过氧化氢分解反应放热,使乙中温度升高,达到白磷着火点.
(2)如图2所示:若装置甲中加入大理石和过量的稀盐酸,装置乙中加入滴有无色酚酞的氢氧化钠溶液.打开a,关闭b,Ⅱ中发生的反应方程式为CO2+2NaOH═Na2CO3+H2O.一段时间后,关闭a,打开b,装置Ⅱ中最终得到无色溶液且产生白色混浊,则Ⅱ中无色溶液的溶质可能为NaCl、酚酞或NaCl、CaCl2、酚酞(写出所有可能情况).
分析 (1)根据关闭止水夹,生成的气体使装置内压强增大,液体被压入乙中分析;根据关闭止水夹前后,液体被压入乙中,过氧化氢分解反应放热分析;
(2)二氧化碳和氢氧化钠反应生成碳酸钠和水;根据实验现象可以判断溶液中溶质的组成.
解答 解:(1)关闭止水夹,生成的气体使装置内压强增大,液体被压入乙中,因此乙中的液面上升;关闭止水夹前后,液体被压入乙中,过氧化氢分解反应放热,使乙中温度升高,达到白磷着火点,又与生成的氧气接触,因此白磷燃烧;
(2)打开a,关闭b,二氧化碳进入氢氧化钠溶液中,Ⅱ中发生反应的化学方程式为:CO2+2NaOH═Na2CO3+H2O.
若装置Ⅱ中最终得到无色溶液且产生白色混浊,则II中无色溶液的溶质可能为NaCl、酚酞或NaCl、CaCl2、酚酞.
故答案为:(1)液面上升;液体被压入乙中,过氧化氢分解反应放热,使乙中温度升高,达到白磷着火点;
(2)CO2+2NaOH═Na2CO3+H2O;NaCl、酚酞或NaCl、CaCl2、酚酞
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.实验室中有久置的四瓶无色溶液,标签破损,只知道它们分别是稀硫酸、氢氧化钠溶液、碳酸钠溶液、氯化钠溶液.为鉴别它们,实验过程如下:
(1)甲同学取四中溶液少许于四支试管中,分别向其中滴加紫色石蕊试液,能鉴别出来的溶液是稀硫酸、氯化钠溶液.
(2)为鉴别剩余两种溶液,乙同学继续进行了以下实验设计.
(3)丙同学按照乙同学的方案进行实验,结果两支试管中都观察到了明显的现象,其可能的原因是氢氧化钠吸收空气中的二氧化碳生成了碳酸钠.
(4)实验结束后,同学们认为在实验室中使用和存放药品时应注意:①正确倾倒液体,保护好标签;②密封保存.
(1)甲同学取四中溶液少许于四支试管中,分别向其中滴加紫色石蕊试液,能鉴别出来的溶液是稀硫酸、氯化钠溶液.
(2)为鉴别剩余两种溶液,乙同学继续进行了以下实验设计.
| 实验操作 | 实验现象与化学方程式 |
| 分别取两溶液于两支试管中,分别向其中滴加稀盐酸. | 一支试管中有明显现象:有气体生成化学方程式:Na2CO3+2HCl═2NaCl+H2O+CO2↑. |
| 另一只试管中无明显现象 |
(4)实验结束后,同学们认为在实验室中使用和存放药品时应注意:①正确倾倒液体,保护好标签;②密封保存.
20.决定元素化学性质的是( )
| A. | 质子数 | B. | 中子数 | C. | 电子总数 | D. | 最外层电子数 |
17.为了测定某生铁样品中铁的质量分数,某化学兴趣小组取生铁样品10g,将200g稀硫酸粉4次加入样品中,称得剩余固体的质量与所加稀硫酸的质量关系如下图所示:
(1)求生铁样品中铁的质量.
(2)计算所用稀硫酸的溶质质量分数.
| 所用稀硫酸的质量(g) | 50 | 50 | 50 | 50 |
| 剩余固体的质量(g) | 7.2 | 4.4 | 1.6 | 0.2 |
(2)计算所用稀硫酸的溶质质量分数.
14. 根据图甲、乙、丙三种物质的转化关系,推测甲为( )
根据图甲、乙、丙三种物质的转化关系,推测甲为( )
 根据图甲、乙、丙三种物质的转化关系,推测甲为( )
根据图甲、乙、丙三种物质的转化关系,推测甲为( )| A. | 铜 | B. | 碳酸钠 | C. | 氧化铜 | D. | 氢氧化钡 |
 如图所示是镁原子的结构示意图,根据图示回答:镁原子在化学变化中容易失去(填“得到”或“失去”)电子,成为离子,镁离子的符号是Mg2+.
如图所示是镁原子的结构示意图,根据图示回答:镁原子在化学变化中容易失去(填“得到”或“失去”)电子,成为离子,镁离子的符号是Mg2+.