题目内容
3.海水中含有浓度较低的MgCl2,从海水中获取金属镁的流程示意图如下: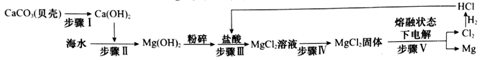
已知Mg(OH)2是一种难溶于水的白色固体,回答下列问题:
(1)步骤Ⅰ通过两步反应才可以实现,写出其中一个反应的化学方程式:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,或CaO+H2O═Ca(OH)2
(2)步骤Ⅳ是将MgCl2溶液在氯化氢气氛中蒸发得到MgCl2固体,蒸发操作中除了需要铁架台(带铁圈),玻璃棒,坩埚钳,还需要的仪器是酒精灯、蒸发皿.
(3)步骤Ⅴ中发生反应的基本反应类型是分解反应,加入盐酸前,将Mg(OH)2粉碎的目的是增大反应物接触面积,加快反应速率
(4)写出镁的一种用途:用作照明弹.
分析 高温条件下,碳酸钙分解生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙;
氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,氢氧化镁和稀盐酸反应生成氯化镁和水,电解氯化镁生成镁和氯气;
镁在空气中燃烧时能够发出耀眼的白光.
解答 解:(1)步骤Ⅰ通过两步反应才可以实现,即高温条件下,碳酸钙分解生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+H2O═Ca(OH)2.
故填:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,或CaO+H2O═Ca(OH)2.
(2)蒸发操作中除了需要铁架台(带铁圈),玻璃棒,坩埚钳,还需要的仪器是酒精灯、蒸发皿.
故填:酒精灯、蒸发皿.
(3)步骤Ⅴ中,电解氯化镁生成镁和氯气,属于分解反应;
加入盐酸前,将Mg(OH)2粉碎的目的是增大反应物接触面积,加快反应速率.
故填:分解反应;增大反应物接触面积,加快反应速率.
(4)镁在空气中燃烧时能够发出耀眼的白光,可以用作照明弹.
故填:用作照明弹.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
13.在四个相同的烧杯中,分别装入质量相等的浓硫酸、浓盐酸、氢氧化钠溶液、食盐水.久置在空气中,则对杯底压强变大的是( )
| A. | 浓硫酸、浓盐酸 | B. | 浓盐酸、氢氧化钠溶液 | ||
| C. | 氢氧化钠溶液、食盐水 | D. | 浓硫酸、氢氧化钠溶液 |