题目内容
13.在四个相同的烧杯中,分别装入质量相等的浓硫酸、浓盐酸、氢氧化钠溶液、食盐水.久置在空气中,则对杯底压强变大的是( )| A. | 浓硫酸、浓盐酸 | B. | 浓盐酸、氢氧化钠溶液 | ||
| C. | 氢氧化钠溶液、食盐水 | D. | 浓硫酸、氢氧化钠溶液 |
分析 根据物质的性质分析发生的变化,浓硫酸具有吸水性,浓盐酸就要挥发性,食盐水在空气中不发生变化,氢氧化钠溶液能吸收空气中二氧化碳,溶液的质量增加,则对杯底的压强增大.
解答 解:浓硫酸具有吸水性,质量要增加;浓盐酸具有挥发性,挥发出氯化氢气体,使溶质HCl减少,所以溶液质量减少;氢氧化钠溶液会吸收空气中的二氧化碳和水,质量要增加;食盐水在空气中不发生变化,溶液质量不变.溶液的质量增加,则对杯底的压强增大,因此对杯底压强变大的是浓硫酸和氢氧化钠溶液.
故选D.
点评 此题是对常见物质特性的考查,解题的关键是要知道这些物质在空气中发生了什么变化,属基础性知识考查题.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
4.某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
(1)从以上数据可知,m的值为2.5g;
(2)计算整个实验过程中总共生成氢气的质量是多少?
(3)计算所用稀硫酸中H2SO4的质量分数?
| 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | mg |
| 第二次加入10g | 2.0g |
| 第三次加入10g | 1.5g |
| 第四次加入10g | 1.0g |
| 第五次加入10g | 0.6g |
| 第六次加入10g | 0.6g |
(2)计算整个实验过程中总共生成氢气的质量是多少?
(3)计算所用稀硫酸中H2SO4的质量分数?
5.为除去下列物质中的杂质(括号内是杂质),所选用的除杂试剂和分离方法都正确的是( )
| 序号 | 物质(括号内为杂质) | 除杂试剂 | 分离方法 |
| A | 硫酸铜溶液(硫酸) | 氧化铜 | 过滤 |
| B | NaOH溶液[Ca(OH)2溶液] | 二氧化碳 | 过滤 |
| C | 二氧化碳(一氧化碳) | 氢氧化钠溶液 | 洗气 |
| D | 二氧化锰粉末(碳粉) | 水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
2.在下列化合物中,铁的质量分数最高的是( )
| A. | Fe2O3 | B. | Fe3O4 | C. | FeO | D. | FeS |
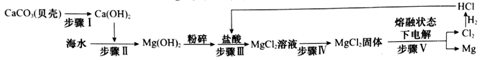

 如图为精制粗盐的示意图,回答:
如图为精制粗盐的示意图,回答: