题目内容
8.如图为以海水为原料制取氢氧化钠溶液的实验流程: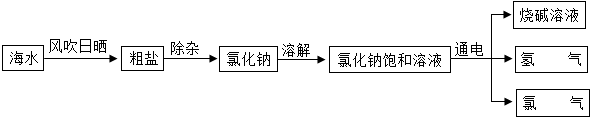
(1)由海水得到粗盐的原理是蒸发结晶.
(2)氯化钠饱和溶液在通电条件下发生反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)粗盐提纯实验的步骤中都要使用的一种玻璃仪器是玻璃棒,其中在过滤时该仪器的作用是引流.
(4)将氯气通入氢氧化钠溶液发生的反应是2NaOH+Cl2═NaCl+NaClO+X,X的化学式是H2O,请你写出氯化钠的一点其他用途用作调味品.
分析 (1)由海水得到粗盐的原理是蒸发结晶;
(2)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
(3)粗盐提纯实验的步骤中都要使用的一种玻璃仪器是玻璃棒,其中在过滤时该仪器的作用是引流;
(4)反应前后元素种类不变,原子种类和总个数都不变;
氯化钠可以用作调味品、制取纯碱等.
解答 解:(1)由海水得到粗盐的原理是蒸发结晶.
故填:蒸发结晶.
(2)氯化钠饱和溶液在通电条件下发生反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
故填:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)粗盐提纯实验的步骤中都要使用的一种玻璃仪器是玻璃棒,其中在过滤时该仪器的作用是引流.
故填:玻璃棒;引流.
(4)由2NaOH+Cl2═NaCl+NaClO+X可知,反应前后钠原子、氯原子都是2个,反应前氢原子是2个,反应后应该是2个,包含在X中,反应前氧原子是2个,反应后应该是2个,其中1个包含在X中,X的化学式是H2O;
氯化钠可以用作调味品、制取纯碱等.
故填:H2O;用作调味品.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
20.物质的用途错误的是( )
| A. | 盐酸:制药 | B. | 氢氧化钠:改良土壤 | ||
| C. | 食盐:制烧碱 | D. | 硫酸铵:作化肥 |
 小敏对实验用石灰石和稀盐酸制取二氧化碳后的废液,进行溶质成分鉴定,取废液上层清液50克,逐滴加入质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,测得沉淀的质量为5克,并绘制了图象.
小敏对实验用石灰石和稀盐酸制取二氧化碳后的废液,进行溶质成分鉴定,取废液上层清液50克,逐滴加入质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,测得沉淀的质量为5克,并绘制了图象.