题目内容
4.掌握化学用语是学好化学的关键,下列化学用语与所表达的意义相符合的是( )①FeCl2--氯化亚铁 ②2Ca2+--2个钙离子 ③O2--2个氧原子 ④2H--2个氢元素 ⑤H2O--1个水分子 ⑥$\stackrel{+1}{Na}$--钠离子 ⑦$\stackrel{0}{{N}_{2}}$--氮气中氮元素的化合价为零.
| A. | ①④⑤⑦ | B. | ②③④⑥ | C. | ①②⑤⑦ | D. | ②⑤⑥⑦ |
分析 本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.
解答 解:①根据化合物的读法,FeCl2可读作氯化亚铁,化学用语与所表述的意义相符合;
②离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字,故2Ca2+表示2个钙离子;化学用语与所表述的意义相符合;
③原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.所以2个氧原子,就可表示为:2O;化学用语与所表述的意义不相符合;
④2H表示2个氢原子,元素不论个数,只论种类;化学用语与所表述的意义不相符合;
⑤H2O可以表示1个水分子,化学用语与所表述的意义相符合;
⑥Na+表示1个钠离子,$\stackrel{+1}{Na}$表示+1价的钠元素,化学用语与所表述的意义不相符合;
⑦元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以$\stackrel{0}{N}$2表示氮气中氮元素的化合价为零;化学用语与所表述的意义相符合;
故选C.
点评 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
14.鸡蛋主要由蛋壳、蛋壳膜、蛋白、蛋黄等几个部分组成,如图1,其中蛋壳的主要成分是CaCO3,里面覆盖一层蛋壳膜.我校兴趣小组的同学为此开展了以下探究活动:
【提出问题1】
(1)鸡蛋白中主要的营养成分是蛋白质;
【查阅资料】
a、CaCO3灼烧分解生成氧化钙和一种无毒的氧化物.
b、蛋壳中的其它成分不参加反应.
c、NaHCO3+HCl═NaCl+H2O+CO2↑,Ba(OH)2+CO2═BaCO3↓+H2O,
d、已知仪器a装有10%的稀盐酸,其他成分均不与HCl反应,装置内试剂均足量.
【提出问题2】
蛋壳中的CaCO3含量是多少呢?小华拟将该蛋壳放在空气中充分灼烧完成测定;小明拟通过蛋壳与稀盐酸反应完成测定.请你参与他们的探究.
【设计方案】他们分别称取12.0g蛋壳设计了以下不同的实验方案:
(2)小华的方案:
称取12.0g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16g.则:减少的质量是CO2(填化学式)的质量,经计算得蛋壳中的CaCO3的质量分数为91.7%.
(3)小明的方案:小明设计了如图2所示的实验装置.
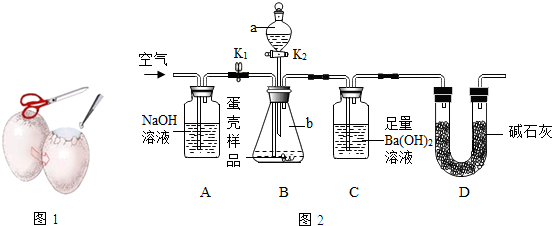
【实验步骤】
①按图2连接好装置后,并检验装置气密性;
②向B装置中加入蛋壳样品后,先通入空气一会儿;
③接下来的实验操作是关闭K1,打开K2,加入稀盐酸,直到没有气泡产生为止(填实验现象);
④再通入空气一会儿,至装置C中不再产生沉淀为止;
⑤将装置C中的固液混合物过滤、洗涤、烘干后称量其质量;
⑥重复上述实验.
【实验数据】重复实验,3次数据记录如表:
【实验分析及数据整理】
①上述数据能否用托盘天平称量不能.(填“能”或“不能”)
②若无A装置,直接通入空气,则测定结果将偏大.(填“偏大”、“偏小”或“不变”)
③实验重复3次的目的是减小实验误差.
④请利用3次实验数据的平均值,计算该蛋壳中的CaCO3质量分数83.3%.
【实验反思】
下列各项措施中,能提高小明测定准确度的是Ⅱ(填序号).
Ⅰ.在装置A、B之间增加盛有浓硫酸的洗气瓶
Ⅱ.缓缓滴加稀盐酸
Ⅲ.在装置B、C之间增加盛有饱和NaHCO3的洗气瓶.
【提出问题1】
(1)鸡蛋白中主要的营养成分是蛋白质;
【查阅资料】
a、CaCO3灼烧分解生成氧化钙和一种无毒的氧化物.
b、蛋壳中的其它成分不参加反应.
c、NaHCO3+HCl═NaCl+H2O+CO2↑,Ba(OH)2+CO2═BaCO3↓+H2O,
d、已知仪器a装有10%的稀盐酸,其他成分均不与HCl反应,装置内试剂均足量.
【提出问题2】
蛋壳中的CaCO3含量是多少呢?小华拟将该蛋壳放在空气中充分灼烧完成测定;小明拟通过蛋壳与稀盐酸反应完成测定.请你参与他们的探究.
【设计方案】他们分别称取12.0g蛋壳设计了以下不同的实验方案:
(2)小华的方案:
称取12.0g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16g.则:减少的质量是CO2(填化学式)的质量,经计算得蛋壳中的CaCO3的质量分数为91.7%.
(3)小明的方案:小明设计了如图2所示的实验装置.

【实验步骤】
①按图2连接好装置后,并检验装置气密性;
②向B装置中加入蛋壳样品后,先通入空气一会儿;
③接下来的实验操作是关闭K1,打开K2,加入稀盐酸,直到没有气泡产生为止(填实验现象);
④再通入空气一会儿,至装置C中不再产生沉淀为止;
⑤将装置C中的固液混合物过滤、洗涤、烘干后称量其质量;
⑥重复上述实验.
【实验数据】重复实验,3次数据记录如表:
| 实验次数 | 实验1 | 实验2 | 实验3 |
| 装置C中沉淀质量(g) | 19.68 | 19.75 | 19.67 |
①上述数据能否用托盘天平称量不能.(填“能”或“不能”)
②若无A装置,直接通入空气,则测定结果将偏大.(填“偏大”、“偏小”或“不变”)
③实验重复3次的目的是减小实验误差.
④请利用3次实验数据的平均值,计算该蛋壳中的CaCO3质量分数83.3%.
【实验反思】
下列各项措施中,能提高小明测定准确度的是Ⅱ(填序号).
Ⅰ.在装置A、B之间增加盛有浓硫酸的洗气瓶
Ⅱ.缓缓滴加稀盐酸
Ⅲ.在装置B、C之间增加盛有饱和NaHCO3的洗气瓶.
15.高纯氧化钙是用于电子工业重要的无机化工原料.用硝酸钙溶液制备高纯氧化钙的工艺流程如下:
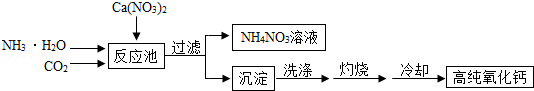
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 过滤后所得沉淀表面一定含有的可溶性杂质是NH4NO3 | |
| B. | 冷却需在干燥的环境中进行,否则制得的高纯氧化钙中会混有杂质Ca(OH)2 | |
| C. | 制备高纯氧化钙的工艺流程中生成的沉淀是CaCO3 | |
| D. | 该工艺流程中可以循环使用的物质有NH4NO3和CO2 |
12.某班同学在实验室制取二氧化碳,老师观察到了四个同学的如下操作,其中正确的是( )
| A. |  连接仪器 | B. |  检查气密性 | C. |  取用石灰石 | D. |  验满 |
19.对实验现象的认真分析,有助于我们理解科学本质.下列报据实验现象得出的结论中正确的是( )
| A. | 某黑色固体能使红墨水褪色,则该固体一定是活性炭 | |
| B. | 向某溶液中滴加紫色石蕊溶液,溶液变蓝,則该溶液一定是碱溶液 | |
| C. | 将燃着的木条伸入集气瓶内.木条火焰立即熄灭,则该瓶气体一定是二氧化碳 | |
| D. | 将干冷的烧杯罩在蜡烛火焰上方,烧杯内壁有水雾,证明蜡烛中一定含有氢元素 |
9.下列物品中的主要材料不属于有机合成材料的是( )
| A. | 尼龙绳 | B. | 塑料桶 | C. | 橡胶轮胎 | D. | 蚕丝 |
13.要除去下列各组物质中的少量杂质,所选试剂和方法不可行的是( )
| 选项 | 物质 | 杂质 | 试剂、方法 |
| A | O2 | 水蒸气 | 通过浓H2SO4 |
| B | C | CuO | 加入过量的H2SO4溶液,过滤 |
| C | NaCl溶液 | BaCl2 | 加入过量的Na2CO3溶液,过滤 |
| D | FeSO4溶液 | CuSO4 | 加入过量的铁粉、过滤 |
| A. | A | B. | B | C. | C | D. | D |
14.一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量分数如下:
下列说法正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量分数 | 48% | 25% | 10% | 17% |
| 反应后质量分数 | 30% | 41% | 10% | 19% |
| A. | 丁一定是化合物 | |
| B. | 该反应可能是碳酸钙分解 | |
| C. | 丙一定是该反应的催化剂 | |
| D. | 甲物质中元素的种类等于乙和丁物质中元素种类之和 |