题目内容
14.一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量分数如下:| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量分数 | 48% | 25% | 10% | 17% |
| 反应后质量分数 | 30% | 41% | 10% | 19% |
| A. | 丁一定是化合物 | |
| B. | 该反应可能是碳酸钙分解 | |
| C. | 丙一定是该反应的催化剂 | |
| D. | 甲物质中元素的种类等于乙和丁物质中元素种类之和 |
分析 本题可分析甲~丁四种物质反应前后各物质的质量分数,确定是反应物还是生成物,据此结合题意进行分析判断即可.
解答 解:由四种物质反应前后各物质的质量分数可知,反应前后甲的质量分数减少了48%-30%=18%,故甲是反应物;同理可以确定乙的质量分数增加了41%-25%=16%,故乙是生成物;丙的质量分数不变,可能作该反应的催化剂,也可能是杂质没有参加反应.丁的质量分数增加了19%-17%=2%,丙是生成物;
该反应中乙、丙是生成物,甲质量减少,为反应物,符合“一变多”的特点,为分解反应.故:
A、由分析可知:丁是生成物,可能是化合物,故选项说法错误;
B、该反应中,甲乙丁三种物质的质量比为:18:16:2=9:8:1,不符合碳酸钙受热分解各物质的质量比,故错误;
C、丙的质量分数不变,可能没有参加反应,也可能作该反应的催化剂,故选项说法错误;
D、甲→乙+丁,根据质量守恒定律,反应前后元素的种类不变,甲物质中元素的种类等于乙和丁物质中元素种类之和,故正确.
故选D.
点评 本题难度不大,考查的是质量守恒定律的应用,解题的关键是分析图中数据,灵活运用质量守恒定律.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
4.掌握化学用语是学好化学的关键,下列化学用语与所表达的意义相符合的是( )
①FeCl2--氯化亚铁 ②2Ca2+--2个钙离子 ③O2--2个氧原子 ④2H--2个氢元素 ⑤H2O--1个水分子 ⑥$\stackrel{+1}{Na}$--钠离子 ⑦$\stackrel{0}{{N}_{2}}$--氮气中氮元素的化合价为零.
①FeCl2--氯化亚铁 ②2Ca2+--2个钙离子 ③O2--2个氧原子 ④2H--2个氢元素 ⑤H2O--1个水分子 ⑥$\stackrel{+1}{Na}$--钠离子 ⑦$\stackrel{0}{{N}_{2}}$--氮气中氮元素的化合价为零.
| A. | ①④⑤⑦ | B. | ②③④⑥ | C. | ①②⑤⑦ | D. | ②⑤⑥⑦ |
5.废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),动物饲料硫酸亚铁的生产工艺之一如图所示:
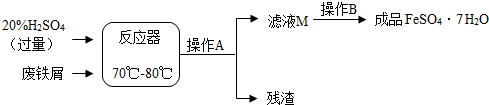
(1)在反应器中发生反应的化学方程式除 Fe2(SO4)3+Fe=3FeSO4外,还有Fe+H2SO4═FeSO4+H2↑;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
(2)滤液 M 中肯定含有的溶质的离子是Fe2+、H+、SO42-(填离子符号).
(3)在实验室中完成操作 A 的名称是过滤.
(4)滤液 M 经过操作 B 可得硫酸亚铁晶体(FeSO4•7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
根据溶解度表,硫酸亚铁晶体(FeSO4•7H2O)冷却结晶温度最高不超过60℃.

(1)在反应器中发生反应的化学方程式除 Fe2(SO4)3+Fe=3FeSO4外,还有Fe+H2SO4═FeSO4+H2↑;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
(2)滤液 M 中肯定含有的溶质的离子是Fe2+、H+、SO42-(填离子符号).
(3)在实验室中完成操作 A 的名称是过滤.
(4)滤液 M 经过操作 B 可得硫酸亚铁晶体(FeSO4•7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
6.蔗糖(C12H22O11)在甜菜、甘蔗中含量极高.下列有关C12H22O11的说法正确的是( )
| A. | C12H22O11属于氧化物 | |
| B. | 一个蔗糖分子中碳原子的质量为144g | |
| C. | C12H22O11中氢元素的质量分数最大 | |
| D. | C12H22O11中氢、氧原子的个数比为2:1 |
3.下列物质中碳元素的化合价为+4的是( )
| A. | C | B. | CO | C. | CO2 | D. | CH4 |

 如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,回答:(1)P点的含是在t1℃时a和c的溶解度相等.
如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,回答:(1)P点的含是在t1℃时a和c的溶解度相等.