题目内容
3.现有几种常见物质,其中D可用作干燥剂、F为红褐色沉淀、M为固体粉末,它们相互转化关系如图所示.
(1)写出下列物质的化学式:
YC;酸XHCl.
(2)写出下列化学方程式:
①CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;③Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
分析 根据几种常见物质,D可用作干燥剂,所以D是氧化钙,F为红褐色沉淀,所以F是氢氧化铁,M为固体粉末,A高温会生成氧化钙,所以A是碳酸钙,碳酸钙和酸反应会生成二氧化碳,碳酸钙高温也会生成二氧化碳,所以B是二氧化碳,X是盐酸,二氧化碳和碳高温生成一氧化碳,所以Y是碳,C是一氧化碳,氧化钙和水反应生成氢氧化钙,所以E是氢氧化钙,氢氧化钙和G会生成氢氧化铁,所以G是氯化铁,M是氧化铁,氧化铁和一氧化碳高温生成铁和二氧化碳,所以H是铁,氯化铁和硝酸银反应生成氯化银沉淀和硝酸铁,然后将推出的物质进行验证即可.
解答 解:(1)几种常见物质,D可用作干燥剂,所以D是氧化钙,F为红褐色沉淀,所以F是氢氧化铁,M为固体粉末,A高温会生成氧化钙,所以A是碳酸钙,碳酸钙和酸反应会生成二氧化碳,碳酸钙高温也会生成二氧化碳,所以B是二氧化碳,X是盐酸,二氧化碳和碳高温生成一氧化碳,所以Y是碳,C是一氧化碳,氧化钙和水反应生成氢氧化钙,所以E是氢氧化钙,氢氧化钙和G会生成氢氧化铁,所以G是氯化铁,M是氧化铁,氧化铁和一氧化碳高温生成铁和二氧化碳,所以H是铁,氯化铁和硝酸银反应生成氯化银沉淀和硝酸铁,经过验证,推导正确,所以Y是C,酸X是HCl;
(2)反应①是碳酸钙在高温的条件下生成氧化钙和二氧化碳,化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
反应③是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
故答案为:(1)C,HCl;
(2)CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

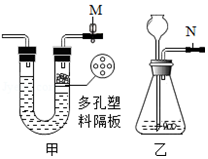
| A. | 此时甲装置中的止水夹M处于关闭状态 | |
| B. | 甲装置气体导出过程中容器内外气压相等 | |
| C. | 甲装置具有控制反应进行与否的功能 | |
| D. | 乙装置N处添加止水夹可以与甲装置具有相同功能 |
| 物质 | 某种金属清洗剂 | 醋 | 硫酸铜溶液 | 肥皂水 |
| pH | 0 | 4 | 接近7 | 10 |
(2)黄蜂的刺是碱性的.若你被黄蜂刺了,临时处理时,最好用上述物质中的醋涂在皮肤上来减轻疼痛.
(3)在铁罐、铝罐和塑料罐中可用于盛放保存硫酸铜溶液的是塑料罐.
| A. | 用广泛pH试纸测得溶液的pH值为3.6 | |
| B. | 用一氧化碳还原氧化钨(WO3)制取钨时,先加热氧化钨,再通入一氧化碳 | |
| C. | 用无水硫酸铜检验酒精里是否含有微量水 | |
| D. | 用100 mL量筒量取5.4 mL NaCl溶液 |
| A. | 硫酸根离子 | B. | 铜离子 | ||
| C. | 水分子 | D. | 硫酸根离子和铜离子 |
| A. | 维生素C的相对分子质量为176 | |
| B. | 维生素C中C、H、0三种元素的质量比为9:1:12 | |
| C. | 维生素C中氢元素的质量分数约为4.5% | |
| D. | 维生素C分子由6个碳原子、8个氢原子、6个氧原子构成 |
【猜想与假设】根据所学知识,猜想三种金属在金属活动性顺序中的相对位置关系:
猜想一:Al Cu Cr;猜想二:Cr Al Cu; 猜想三:Al Cr Cu.
【实验与探究】
(1)小明的实验:取大小相同的表面已打磨光滑的铝、铬、铜三种金属片
| 实验步骤 | 实验现象 | 解释与结论 |
| 分别取三支试管,向其中加入等质量、同浓度的稀硫酸,然后将铝、铬、铜三种金属分别插入三支试管中. | 铝片表面产生的气泡较快,铬片表面产生的气泡较缓慢,铜片表面无明显现象. | 所取稀硫酸需要等质量、同浓度的目的是控制变量. 猜想三成立. 铬与稀硫酸反应生成蓝色的硫酸亚铬(CrSO4)溶液,反应的化学方程式为H2SO4+Cr=CrSO4+H2↑. |
小华只选用了三种药品进行实验,也得出了三种金属在金属活动性顺序中的相对位置关系,你认为小华选择的三种药品可能是铝片、CrSO4溶液、铜片.
【总结与归纳】由上述实验得出比较金属活动性强弱的方法有:
①利用金属和酸反应情况进行比较;②利用金属和盐溶液反应情况进行比较.
(3)少数很不活泼的金属如金、银、铂等在地壳中以单质的形式存在,其余金属都以化合物的形式存在;镁能在空气中燃烧,而铁只能在氧气中或氧气含量更高的空气中燃烧.据此分析,比较金属的活泼性强弱还可以根据:
③金属在地壳中的存在形式;④金属跟空气反应的难易程度.
 如图是某试剂瓶标签的部分内容.请回答下列问题:
如图是某试剂瓶标签的部分内容.请回答下列问题: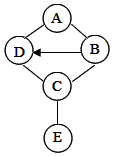 图中A、B、C、D、E是初中化学常见的五种不同类别的物质,A是产量最大的一种金属,E是导致温室效应的一种气体,图中“--”表示相连物质能发生化学反应,“→”表示两种物质间的转化关系(部分反应物、生成物及反应条件省略).
图中A、B、C、D、E是初中化学常见的五种不同类别的物质,A是产量最大的一种金属,E是导致温室效应的一种气体,图中“--”表示相连物质能发生化学反应,“→”表示两种物质间的转化关系(部分反应物、生成物及反应条件省略).