题目内容
13. 如图是某试剂瓶标签的部分内容.请回答下列问题:
如图是某试剂瓶标签的部分内容.请回答下列问题:(1)配制18%的稀盐酸100g,需要这种浓盐酸的体积约为42.4mL
(2)某同学想测试一包含有杂质的碳酸钙固体的纯度,取该固体8g,加入以上配制的质量分数为18%的盐酸至不再产生气泡为止,共生成气体的质量为2.2g,试计算该包固体中所含碳酸钙的质量分数?(可能用到的相对原子质量:H-1、C-12、O-16、Ca-40、Cl-35.5)
分析 (1)用36%的浓盐酸配制18%的稀盐酸,采取的是加水稀释的方法;加水稀释时,稀释前后浓、稀溶液中的溶质质量不变.
(2)碳酸钙能与稀盐酸反应生成二氧化碳气体,由生成二氧化碳气体的质量2.2g,根据反应的化学方程式计算出参加反应的碳酸钙的质量,进而可计算出该包固体中所含碳酸钙的质量分数.
解答 解:(1)18%的稀盐酸100g中溶质的质量为:100g×18%=18g;根据标签内容,该浓盐酸的密度为1.18g/cm3,溶质的质量分数为36%,设需要这种浓盐酸的体积为x,根据稀释前后溶质的质量不变,则18g=1.18g/cm3×x×36%,解得x=42.4cm3=42.4mL,故填:42.4.
(3)设参加反应的碳酸钙的质量为y.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
y 2.2g
$\frac{100}{44}$=$\frac{y}{2.2g}$
y=5g
该包固体中所含碳酸钙的质量分数=$\frac{5g}{8g}$×100%=62.5%.
答:该包固体中所含碳酸钙的质量分数62.5%.
点评 本题难度不大,主要考查学生根据标签数据、有关溶质质量分数的计算、化学方程式的计算进行解决问题的能力,解题时要注意解题的规范性.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
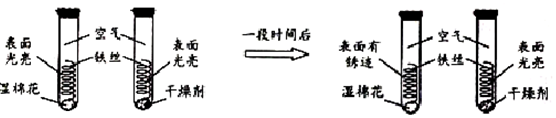
 某化学兴趣小组在做Fe和CuSO4溶液反应实验时,发现生成Cu的同时有气泡产生.为了进一步研究做了如下实验:
某化学兴趣小组在做Fe和CuSO4溶液反应实验时,发现生成Cu的同时有气泡产生.为了进一步研究做了如下实验: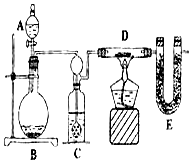 某同学为了测定水中氢、氧两元素的质量比,设计了以下实验,实验装置如图.
某同学为了测定水中氢、氧两元素的质量比,设计了以下实验,实验装置如图.
