题目内容
16.钠是种活泼金属,其化合物在生产、生活中有着重要的作用,下列是一些含钠化合物:Na2O2、NaCl、Na2CO3、NaHCO3、NaOH.
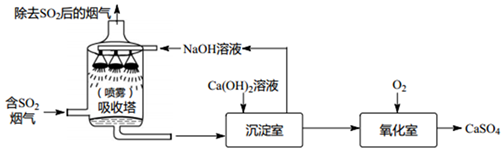
(1)实际生产中,经常利用NaOH溶液来“捕捉”CO2,流程如图(部分条件及物质未标出),捕捉室内发生的化学反应方程式为2NaOH+CO2═Na2CO3+H2O;“反应分离”过程中发生的化学反应除CaO+H2O=Ca(OH)2外,还会发生另一个化学反应,其化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.

(2)该生产流程中设计到有一种可以循环利用的碱的是NaOH.(填写化学式)
分析 根据流程图、物质间的反应以及化学方程式的书写的知识进行分析解答即可.
解答 解:(1)捕捉室内氢氧化钠能与二氧化碳反应生成碳酸钠和水,反应分离中氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故填:2NaOH+CO2═Na2CO3+H2O;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)根据流程图可以看出,该过程中能循环利用的物质是氢氧化钠,故填:NaOH.
点评 本题考查的是常见的碱的性质以及化学方程式的书写,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
7.物质的用途与性质密切相关.下列说法错误的是( )
| A. | 铜用于制导线,是由于铜有良好的导电性 | |
| B. | 二氧化碳能够灭火,是由于其不燃烧、不支持燃烧,且密度比空气大 | |
| C. | 氮气常用作保护气,是由于氮气的化学性质稳定 | |
| D. | 铁制品表面涂“银粉”(铝粉),是由于铝的化学性质比铁稳定 |
4.下列有关乙酸乙酯(化学式为C4H8O2)的叙述正确的是( )
| A. | 乙酸乙酯完全氧化后生成二氧化碳和水 | |
| B. | 乙酸乙酯由碳、氢、氧原子构成 | |
| C. | 乙酸乙酯中碳、氧元素的质量比为2:1 | |
| D. | 乙酸乙酯是由碳、氢、氧元素组成的氧化物 |
 已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示:
已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示: 某兴趣小组为了测定鸡蛋壳(主要成分是碳酸钙)中碳酸钙的含量,现取7.8g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入47.2g某浓度的稀盐酸,恰好完全反应(鸡蛋壳中除碳酸钙外,其他成分不与稀盐酸反应也不溶于水),测得烧杯中的反应剩余物的质量与反应时间的关系如图所示(忽略水分的蒸发).
某兴趣小组为了测定鸡蛋壳(主要成分是碳酸钙)中碳酸钙的含量,现取7.8g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入47.2g某浓度的稀盐酸,恰好完全反应(鸡蛋壳中除碳酸钙外,其他成分不与稀盐酸反应也不溶于水),测得烧杯中的反应剩余物的质量与反应时间的关系如图所示(忽略水分的蒸发).