题目内容
5.某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂.因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究.【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;
猜想二:可能只有CaCl2;
猜想三:可能是CaCl2和HCl.
【查阅资料】氯化钙溶液呈中性.
【方案设计】
| 方案 | 方法步骤 | 实验现象 | 实验结论 |
| 方案一 | 取少量烧杯内的溶液于试管中,滴入几滴无色酚酞溶液 | 溶液不变红色 | 猜想一不正确 |
| 方案二 | 取少量烧杯内的溶液于试管中,逐滴加入碳酸钠溶液至过量 | 溶液变红色 | 猜想二不正确猜想三正确 |
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物的用量.
(2)随着大家环保意识的增强,实验室产生的污染越来越受到重视,实验中产生的污染物必须无害化处理后再排放.要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的碳酸钙.
分析 【猜想】根据反应过程中各种反应物之间的用量进行分析解答;
【进行实验】根据酸碱指示剂在酸、碱、盐中的显色进行分析;
【反思与拓展】
(2)根据酸会与金属发生反应进行分析,依据除杂的原则进行分析解答.
解答 解:【猜想】
实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验,所以盐酸和氢氧化钙可能刚好反应,反应后的溶质是猜想二,可能氢氧化钙过量,反应后的溶质是猜想一,也可能是盐酸过量,反应后的溶质是氯化钙和氯化氢,所以猜想三是:可能是CaCl2和HCl;
【进行实验】
因为酚酞遇碱会变红色,而结论是猜想一不正确,即不含有氢氧化钙,所以观察到的现象是溶液不变红色;
因为紫色石蕊遇酸会变红色,而猜想二不正确,猜想三正确,即含有盐酸,所以观察到的现象是溶液变红色;
| 实验步骤 | 实验现象 | 结论 |
| 溶液不变红色 | ||
| 溶液变红色 |
(2)盐酸会与铁反应而腐蚀下水道,处理烧杯内溶液,使其溶质只含有CaCl2,碳酸钙和盐酸反应会生成氯化钙、水和二氧化碳,所以应向烧杯中加入过量的:碳酸钙.
故答案为:【猜想】可能是CaCl2和HCl;
【进行实验】
| 实验步骤 | 实验现象 | 结论 |
| 溶液不变红色 | ||
| 溶液变红色 |
(2)碳酸钙.
点评 本题主要考查了酸碱中和反应以及实验设计的能力,设计实验时,可以从反应后的产物和其有关的性质着手,检验时要注意氯离子的干扰.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
6.下列物质中颜色为黑色的是( )
①氧化铜 ②炭粉 ③铁粉 ④铁片.
①氧化铜 ②炭粉 ③铁粉 ④铁片.
| A. | ①②③④ | B. | ①③ | C. | ①②③ | D. | ①②④ |
14.几位同学在探究二氧化锰、氧化铜、氧化铁对过氧化氢溶液分解速率的影响时,他们在控制变量的问题上提出了不同的观点,你认为不正确的是( )
| A. | 过氧化氢溶液中溶质的质量分数一定相同 | |
| B. | 催化剂的质量一定相同 | |
| C. | 反应前过氧化氢溶液的温度一定相同 | |
| D. | 反应容器的体积一定相同 |
15.下列物质中,属于钾肥的是( )
| A. | 硝酸钾KNO3 | B. | 硫酸钾K2SO4 | ||
| C. | 尿素CO(NH2)2 | D. | 磷酸二氢钙Ca(H2PO4)2 |
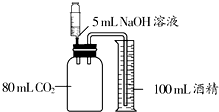 下列三个实验均可证明CO2能与NaOH溶液反应.
下列三个实验均可证明CO2能与NaOH溶液反应.