题目内容
1.金属铁、铝、铜在生产和生活中有广泛的应用.(1)地壳中含量最多的金属元素是铝.
(2)金属铜做导线是利用其延展性和导电性.
(3)铁是应用最广泛的金属.工业常用赤铁矿(主要成分Fe2O3)和一氧化碳在高温条件下炼铁,该反应的化学方程式为3CO+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(4)实验室中用如下实验来研究铁、铝、铜三种金属活动顺序及其在活动顺序表中相对氢的位置.
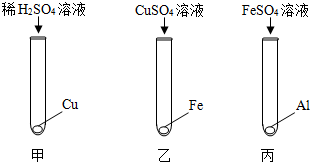
①乙实验的现象为铁表面附着红色固体,溶液由蓝色变为浅绿色
②若将上述实验之一替换掉一种药品,即可达成实验目的.说明具体的改进方法:将乙实验中的硫酸铜溶液换为稀硫酸
③按如图实验结束后,将乙、丙实验后的剩余物倾倒至一个烧杯中,充分反应.然后将甲实验的剩余物倒入此烧杯,无气泡产生.以下说法正确的是AB(填序号).
A.最后烧杯中的溶液不可能是无色的
B.乙实验中,CuSO4溶液一定是过量的
C.乙、丙混合过程中,可能没有发生化学反应
D.最后烧杯中的溶液,一定含有Al2(SO4)3,可能含有FeSO4.
分析 (1)根据地壳中含量最多的金属元素是铝;
(2)金属铜做导线是利用其延展性和导电性;
(3)根据化学方程式的书写步骤书写,一氧化碳还原氧化铁生成铁和二氧化碳.
(4)①根据铁能与硫酸铜反应解答;
②根据验证金属活动性顺序的反应选择药品;
③将甲实验的剩余物倒入此烧杯,无气泡产生,说明剩余物无铁和铝;故溶液中要含有亚铁离子,最后烧杯中的溶液不可能是无色的;乙、丙实验后的剩余物倾倒至一个烧杯中剩余物无铁和铝,说明乙实验中,CuSO4溶液一定是过量的
解答 解:(1)地壳中含量最多的金属元素是铝;
(2)金属铜做导线是利用其延展性和导电性;
(3)用赤铁矿和一氧化碳在高温条件下炼铁是化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe;
(4)①铁能与硫酸铜反应铁表面附着红色固体,溶液由蓝色变为浅绿色.
②若将上述实验之一替换掉一种药品,即可达成实验目的.由于铁排在氢的前面,铜排在氢的后面,故可以将乙实验中的硫酸铜溶液换为稀硫酸;
③将甲实验的剩余物倒入此烧杯,无气泡产生,说明剩余物无铁和铝;故溶液中要含有亚铁离子,最后烧杯中的溶液不可能是无色的;乙、丙实验后的剩余物倾倒至一个烧杯中剩余物无铁和铝,说明乙实验中,CuSO4溶液一定是过量的.
答案:(1)铝(或Al) (2)导电
(3)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
(4)①铁表面附着红色固体,溶液由蓝色变为浅绿色
②将乙实验中的硫酸铜溶液换为稀硫酸
③AB.
点评 了解有关金属及其锈蚀的相关知识,书写化学方程式时要按步骤规范完成.验证三种金属活动性强弱关系时,通常采取“三取中”即:取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案| A. | KClO3溶液 | B. | MgCl2溶液 | C. | 液态HCl | D. | NaCl晶体 |
| A. | 冰雪融化 | B. | 纸张燃烧 | C. | 车胎爆炸 | D. | 瓷碗破碎 |
| A. | KNO3和HCl | B. | Mg(OH)2和稀H2SO4 | C. | CaCO3和HC1 | D. | CaCl2和Na2CO3 |
| 选项 | 需要区分的物质 | 所加试剂或操作方法 |
| A | 木炭粉和二氧化锰 | ①分别点燃 ②与氧化铜混合,加热 |
| B | 食盐和白糖 | ①尝味道 ②分别溶于水 |
| C | 软水和硬水 | ①分别加适量肥皂水振荡 ②观察颜色 |
| D | 氮气和氧气 | ①用燃着的木条 ②闻气味 |
| A. | A | B. | B | C. | C | D. | D |


