题目内容
12.通过海水提取的粗盐中含有MgCl2、CaCl2、MgSO4、以及泥沙等杂质.以下是一种制备精盐的实验方案(用于沉淀的试剂均过量).请回答下列问题: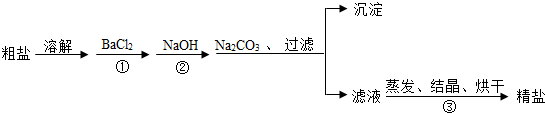
(1)步骤①中的BaCl2不能改成Ba(NO3)2,其原因是什么?会引入无法除去的杂质离子NO3-.
(2)进行步骤①后,如何判断BaCl2是否过量?在上层清液中继续滴加BaCl2溶液,若无沉淀出现,则BaCl2过量,反之未过量.
(3)加人Na2CO3的目的是除去哪些离子?Ca2+、Ba2+.(填离子符号)
(4)按该实验方案制得的精盐并不纯净,其中含有的杂质是氢氧化钠、碳酸钠.(填名称)
分析 (1)根据除杂质的同时不能引入新杂质进行解答;
(2)根据要除去杂质,需加入过量的除杂物质,要判断BaCl2是否过量,可取少量上层清液,继续滴加BaCl2溶液,观察现象进行解答;
(3)根据在②步后,溶液中存在的物质有:未反应的氯化钡、氯化钙,要将钡离子和钙离子除去,可加入碳酸钠进行解答;
(4)根据过滤前的溶液中加入的碳酸钠和氢氧化钠都是过量的,反应后两者都有剩余进行解答.
解答 解:(1)在除杂质的同时不能引入新的杂质,加入硝酸钡会生成新的杂质硝酸钠,这样会在溶液中引入硝酸根离子.
(2)要除去杂质,需加入过量的除杂物质,要判断BaCl2是否过量,可取少量上层清液,继续滴加BaCl2溶液,如没有白色沉淀出现,则说明BaCl2过量;
(3)在②步后,溶液中存在的物质有:未反应的氯化钡、氯化钙,要将钡离子和钙离子除去,但是不能引入新的杂质,所以加入碳酸钠;
(4)过滤后滤液的主要成分有:NaCl、NaOH、Na2CO3,所以按该实验方案制得的精盐并不纯净,其中含有的杂质是氢氧化钠、碳酸钠.
故答案为:
(1)会引入无法除去的杂质离子NO3-.
(2)在上层清液中继续滴加BaCl2溶液,若无沉淀出现,则BaCl2过量,反之未过量.
(3)Ca2+、Ba2+.
(4)氢氧化钠、碳酸钠.
点评 本题主要考查了粗盐提纯实验的过程,及除杂原则:在除去杂质的同时不能引入新的杂质,通过本题能很好的考查学生严密思考,分析、解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.实验室有一瓶无色溶液,标签已模糊,为探究该溶液中的溶质究竟是什么物质,某兴趣小组的同学进行了一系列实验:
(1)小张同学先取该无色溶液少许,滴入紫色石蕊试液,石蕊试液变红,此时可得出的结论是该溶液呈酸性.
(2)小王同学发现尽管试剂瓶标签已模糊,但依稀可见SO4字样.于是,他设计了甲、乙两个方案,并分别取样品实验、记录相关现象.
方案甲:样品$\stackrel{加入足量Ba(NO_{3})_{2}溶液}{→}$产生白色沉淀$\stackrel{加入足量稀HNO_{3}}{→}$沉淀不溶解
方案乙:样品$\stackrel{加入足量稀HCl}{→}$无明显现象$\stackrel{加入足量BaCl_{2}溶液}{→}$产生白色沉淀
上述方案中,能确定该无色溶液中含有硫酸根的方案是方案甲、方案乙;
方案乙中,加入足量稀HCl的作用是排除碳酸根离子和银离子的干扰.
(3)同学们发现标签上还有20.0%的字样,老师告诉他们,这瓶试剂是硫酸、硫酸钠、硫酸镁溶液中的一种.同学通过查阅资料得知,常温下这三种物质的溶解度如下表:
根据上述信息,同学们分析后认为此溶液一定不是Na2SO4Na2SO4溶液,原因是常温下硫酸钠溶液的最大质量分数是17%,不能配置出20%的溶液.
(1)小张同学先取该无色溶液少许,滴入紫色石蕊试液,石蕊试液变红,此时可得出的结论是该溶液呈酸性.
(2)小王同学发现尽管试剂瓶标签已模糊,但依稀可见SO4字样.于是,他设计了甲、乙两个方案,并分别取样品实验、记录相关现象.
方案甲:样品$\stackrel{加入足量Ba(NO_{3})_{2}溶液}{→}$产生白色沉淀$\stackrel{加入足量稀HNO_{3}}{→}$沉淀不溶解
方案乙:样品$\stackrel{加入足量稀HCl}{→}$无明显现象$\stackrel{加入足量BaCl_{2}溶液}{→}$产生白色沉淀
上述方案中,能确定该无色溶液中含有硫酸根的方案是方案甲、方案乙;
方案乙中,加入足量稀HCl的作用是排除碳酸根离子和银离子的干扰.
(3)同学们发现标签上还有20.0%的字样,老师告诉他们,这瓶试剂是硫酸、硫酸钠、硫酸镁溶液中的一种.同学通过查阅资料得知,常温下这三种物质的溶解度如下表:
| 物质 | H2SO4 | Na2SO4 | MgSO4 |
| 溶解度/g | 与水任意比互溶 | 19.0 | 39.0 |
4.下列实验的现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 用浓硫酸在白纸上写字 | 白纸变黑甚至穿孔 | 浓硫酸有强烈的腐蚀性 |
| B | 向稀盐酸中加入氢氧化钠溶液 | 无明显现象 | 二者之间不发生反应 |
| C | 在装有过氧化氢溶液的试管中加入MnO2固体 | 有大量气泡产生 | MnO2是过氧化氢溶液 分解的催化剂 |
| D | 向某溶液滴加BaCl2溶液,振荡 | 有白色沉淀生成 | 该溶液一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
2.下列对一些事实的解释中,不合理的是( )
| 选项 | 事 实 | 解 释 |
| A | 氧化汞受热会得到氧气和汞 | 分子在化学变化中可以再分 |
| B | 盐酸、稀硫酸都能使紫色石蕊试液变红 | 它们所含的阳离子全部都是H+ |
| C | 将墨汁滴入一杯清水中,清水很快变黑 | 分子在不断运动 |
| D | 25m3的氧气可以装入0.024m3的钢瓶中 | 氧分子的体积变小 |
| A. | A | B. | B | C. | C | D. | D |

