题目内容
某氯化钾固体样品中含有少量氯化钙和硫酸镁等杂质,实验室提纯氯化钾流程如图: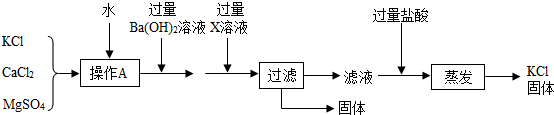
(1)操作A的目的是使样品 .过滤时用到的玻璃仪器有漏斗、烧杯、 .实验过程中发现过滤速度较慢,可能的原因是固体颗粒阻碍了液体通过滤纸孔隙,还可能是 .
(2)加入过量Ba(OH)2溶液除去的杂质离子是(填离子符号) ,反应的化学方程式为 .X溶液中溶质是 (填化学式).若先加过量X溶液,再加过量Ba(OH)2溶液,则蒸发后所得固体中含有的杂质是 .

(1)操作A的目的是使样品
(2)加入过量Ba(OH)2溶液除去的杂质离子是(填离子符号)
考点:混合物的分离方法,酸的化学性质,碱的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:物质的分离和提纯
分析:(1)加入水的目的是使样品充分溶解;根据过滤所用仪器及注意事项分析解答;
(2)根据流程图分析,加入氢氧化钡可以除去硫酸镁,除去氯化钙而又不增加新的杂质用碳酸钾溶液;还要根据反应后溶液的成分进行分析.
(2)根据流程图分析,加入氢氧化钡可以除去硫酸镁,除去氯化钙而又不增加新的杂质用碳酸钾溶液;还要根据反应后溶液的成分进行分析.
解答:解:
(1)加入水的目的是使样品充分溶解形成溶液,便于实验;过滤所用的玻璃仪器是烧杯、漏斗和玻璃棒;实验过程中发现过滤速度较慢,可能的原因是固体颗粒阻碍了液体通过滤纸孔隙,还可能是滤纸没紧贴漏斗内壁,中间留有气泡或滤纸的规格不对等;故答案为:充分溶解;玻璃棒;滤纸没紧贴漏斗内壁;
(2)根据流程图分析,加入氢氧化钡可以除去硫酸镁,反应的化学方程式是Ba(OH)2+MgSO4═BaSO4↓+Mg(OH)2↓;除去氯化钙而又不增加新的杂质用碳酸钾溶液;
若先加过量X溶液,再加过量Ba(OH)2溶液,则蒸发后所得固体中含有的杂质是氯化钡;故答案为:SO42-、Mg2+;Ba(OH)2+MgSO4═BaSO4↓+Mg(OH)2↓;K2CO3;氯化钡.故本题答案为:
(1)充分溶解;玻璃棒;滤纸没有紧贴漏斗内壁;
(2)SO42-、Mg2+;Ba(OH)2+MgSO4═BaSO4↓+Mg(OH)2↓;K2CO3;氯化钡.
(1)加入水的目的是使样品充分溶解形成溶液,便于实验;过滤所用的玻璃仪器是烧杯、漏斗和玻璃棒;实验过程中发现过滤速度较慢,可能的原因是固体颗粒阻碍了液体通过滤纸孔隙,还可能是滤纸没紧贴漏斗内壁,中间留有气泡或滤纸的规格不对等;故答案为:充分溶解;玻璃棒;滤纸没紧贴漏斗内壁;
(2)根据流程图分析,加入氢氧化钡可以除去硫酸镁,反应的化学方程式是Ba(OH)2+MgSO4═BaSO4↓+Mg(OH)2↓;除去氯化钙而又不增加新的杂质用碳酸钾溶液;
若先加过量X溶液,再加过量Ba(OH)2溶液,则蒸发后所得固体中含有的杂质是氯化钡;故答案为:SO42-、Mg2+;Ba(OH)2+MgSO4═BaSO4↓+Mg(OH)2↓;K2CO3;氯化钡.故本题答案为:
(1)充分溶解;玻璃棒;滤纸没有紧贴漏斗内壁;
(2)SO42-、Mg2+;Ba(OH)2+MgSO4═BaSO4↓+Mg(OH)2↓;K2CO3;氯化钡.
点评:本题主要考查了物质的提纯实验的相关的操作要领以及物质除杂的原则(除杂质时加入的试剂只能与杂质反应,不能引入新的杂质,将不溶于液体的固体和液体分离用过滤的方法,把可溶性固体与液体分开用蒸发的方法),要明确流程图中每一步的作用,再结合题意细致分析解答.

练习册系列答案
相关题目
下列物质在氧气中燃烧,产生大量白烟的是( )
| A、硫 | B、铁丝 | C、蜡烛 | D、红磷 |
 实验室有4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数.
实验室有4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数. 红磷燃烧除需要氧气外,还需要满足的条件是什么?
红磷燃烧除需要氧气外,还需要满足的条件是什么? 已知A、B、C、D是初中化学常见的物质.它们之间的转化关系如图所示(部分物质和反应条件略去),其中A被看作是理想的“绿色能源”,B在常温下是无色液体,C可用于灭火.请回答下列问题:
已知A、B、C、D是初中化学常见的物质.它们之间的转化关系如图所示(部分物质和反应条件略去),其中A被看作是理想的“绿色能源”,B在常温下是无色液体,C可用于灭火.请回答下列问题: