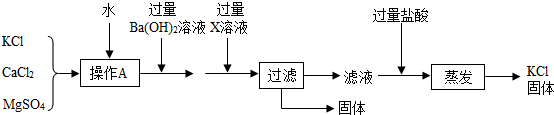
题目内容
 实验室有4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数.
实验室有4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数.(1)恰好完全反应时,消耗4%的氢氧化钠溶液20g和25g某质量分数盐酸溶液,试计算该盐酸溶液中溶质的质量分数为多少?
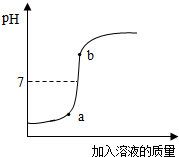
(2)用配得的氢氧化钠溶液与待测溶质质量分数的盐酸溶液反应,实验过程中溶液的pH变化曲线如图所示,那么a点对应的溶液中,在单位体积中微粒数目最多的是
(3)将b点对应的溶液放在蒸发皿中慢慢地蒸干,所得的固体中除了NaCl外,还可能含有
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)两者恰好完全反应,利用此时参加反应的氢氧化钠溶液的质量;然后利用化学方程式的计算可求出参加反应的盐酸中氯化氢的质量,从而计算出其溶质的质量分数.
(2)根据图象可知a点时溶液显酸性,盐酸有剩余,故溶液中的溶质为氯化钠和氯化氢;由氢氧化钠和盐酸的溶质的质量分数可知在单位体积中微粒数目最多的是水分子;
(3)根据pH的变化情况判断酸碱的相互滴加情况和混合液中的溶质成分;
(2)根据图象可知a点时溶液显酸性,盐酸有剩余,故溶液中的溶质为氯化钠和氯化氢;由氢氧化钠和盐酸的溶质的质量分数可知在单位体积中微粒数目最多的是水分子;
(3)根据pH的变化情况判断酸碱的相互滴加情况和混合液中的溶质成分;
解答:解:(1)恰好完全反应时,消耗4%的氢氧化钠溶液20g和25g某质量分数盐酸溶液,设该盐酸溶质的质量分数为x
NaOH+HCl=NaCl+H2O
40 36.5
20g×4% 25gx
=
x=2.92%
答:盐酸溶液中溶质的质量分数为2.92%;
(2)根据图象可知a点时溶液显酸性,盐酸有剩余,故溶液中的溶质为氯化钠和氯化氢;由氢氧化钠和盐酸的溶质的质量分数可知在单位体积中微粒数目最多的是水分子;
(3)b点对应的溶液的pH大于7,说明此时氢氧化钠已经过量,放在蒸发皿中慢慢地蒸干时氢氧化钠能与空气中的二氧化碳反应生成碳酸钠,故溶液中的溶质可能为:NaCl、NaOH、碳酸钠.
答案:(1)盐酸溶液中溶质的质量分数为2.92%;
(2)H2O
(3)NaOH Na2CO3
NaOH+HCl=NaCl+H2O
40 36.5
20g×4% 25gx
| 40 |
| 20g×4% |
| 36.5 |
| 25gx |
x=2.92%
答:盐酸溶液中溶质的质量分数为2.92%;
(2)根据图象可知a点时溶液显酸性,盐酸有剩余,故溶液中的溶质为氯化钠和氯化氢;由氢氧化钠和盐酸的溶质的质量分数可知在单位体积中微粒数目最多的是水分子;
(3)b点对应的溶液的pH大于7,说明此时氢氧化钠已经过量,放在蒸发皿中慢慢地蒸干时氢氧化钠能与空气中的二氧化碳反应生成碳酸钠,故溶液中的溶质可能为:NaCl、NaOH、碳酸钠.
答案:(1)盐酸溶液中溶质的质量分数为2.92%;
(2)H2O
(3)NaOH Na2CO3
点评:做这类题目要会看折点,折点是指图象在变化过程中方向发生了大的转变的那个点.它的出现往往是两个变量中某一变量单方面停止造成的.如果图象涉及化学反应,折点通常是该反应的结束点.对折点的分析关键在于理解该点坐标的含义.

练习册系列答案
相关题目
下列物质的用途是利用其化学性质的是( )
| A、稀有气体用于制霓虹灯 |
| B、金属铁用于制菜刀 |
| C、小苏打用于制糕点 |
| D、金属铜用于制电缆 |

 第22届冬季奥林匹克运动会,于2014年2月7日至23日在俄罗斯联邦索契市举行,乙基雌烯醇是一种参赛运动员禁用的兴奋剂,其化学式为C20H32O.乙基雌烯醇由
第22届冬季奥林匹克运动会,于2014年2月7日至23日在俄罗斯联邦索契市举行,乙基雌烯醇是一种参赛运动员禁用的兴奋剂,其化学式为C20H32O.乙基雌烯醇由