(二)各步反应的化学方程式:

 ①2NaOH+Al2O3=2NaAlO2+H2O; ②NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓;
①2NaOH+Al2O3=2NaAlO2+H2O; ②NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓;
③2Al(OH)3 Al2O3+3H2O; ④2Al2O3 4Al+3O2↑。
[思考感悟]


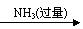
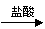 仍以铝土矿为原料,设计另一套可行的提取铝的方案。
仍以铝土矿为原料,设计另一套可行的提取铝的方案。
可按以下流程提取铝:铝土矿 AlCl3溶液 Al(OH)3 Al2O3 Al。
[基础训练]
1、铝在一种重要的金属。
(1)铝在元素周期表中的位置是第3周期,ⅢA族。
 (2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为
2Al+Fe2O3 Al2O3+2Fe。
(3)铝与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;同温同压下,在体积和浓度均为100mL2mol·L-1的盐酸及NaOH溶液中各加入等质量的Al,产生气体的体积之比为5︰6,则所加Al的质量为2.16g。
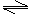 (4)以AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括①加热浓缩,②冷却结晶,③过滤。在①步操作中应注意的事项是:用玻璃棒不断搅拌溶液,当有晶体析出时停止加热。在干燥的HCl气流中加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,其原因是(结合化学方程式简要说明)因存在AlCl3+3H2O Al(OH)3+3HCl,在干燥的HCl气流中,能抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,可得到纯净的AlCl3。
(4)以AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括①加热浓缩,②冷却结晶,③过滤。在①步操作中应注意的事项是:用玻璃棒不断搅拌溶液,当有晶体析出时停止加热。在干燥的HCl气流中加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,其原因是(结合化学方程式简要说明)因存在AlCl3+3H2O Al(OH)3+3HCl,在干燥的HCl气流中,能抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,可得到纯净的AlCl3。
2、若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能大量共存的是( C )
A、NH4+、NO3-、CO32-、K+ B、Na+、K+、Cl-、HCO3-
C、NO3-、AlO2-、K+、Na+ D、NO3-、Cl-、Na+、Fe2+
3、 将0.1mol的镁、铝混合物溶于100mL2mol·L-1的H2SO4溶液中,然后再滴加1mol·L-1的NaOH溶液。请回答:
将0.1mol的镁、铝混合物溶于100mL2mol·L-1的H2SO4溶液中,然后再滴加1mol·L-1的NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160mL时,则金属粉末中n(Mg)=0.06mol,V2=440mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=400mL。
(3)若混合物仍为0.1mol,其中镁粉的物质的量为a,用100mL2mol·L-1的H2SO4溶解此混合物后,再加入450mL1mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是0.05mol≤a<0.1mol。
[高考模拟]
4、(2008广东理基30)下列反应的离子方程式正确的是( C )
A、钠与水反应:Na+H2O=Na++OH-+H2↑
B、氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
C、氢氧化铝中的胃酸:Al(OH)3+3H+=Al3++3H2O
D、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
5、(2007济南模拟)某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”,“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Fe的熔点、沸点数据如下:
|
物质 |
Al |
Fe |
|
熔点(℃) |
660 |
1 535 |
|
沸点(℃) |
2 467 |
2 750 |
(1)某同学推测,铝热反应所得到的熔融物是铁铝合金。理由是:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理?合理(填“合理”或“不合理”)。
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:用磁铁吸引,若能吸附,说明有铁生成。
(3)设计一个简单的实验方案,证明上述所得的熔融物中含有金属铝,请填写下列表格:
|
所用试剂 |
NaOH溶液 |
|
实验操作及现象 |
取少量样品放入试管中,加入NaOH溶液,若有无色气泡产生, 说明该熔融物中有铝 |
|
有关反应的化学方程式 |
2Al+2NaOH+2H2O=3H2↑+2NaAlO2 |
[作业]
 (n=1,2,3,…),若当首项a1和公差d变化时,
(n=1,2,3,…),若当首项a1和公差d变化时, 是一个定值,则下列选项中为定值的是
(
)
是一个定值,则下列选项中为定值的是
(
)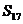 B.
B.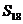 C.
C. D.
D.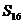
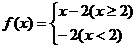 ,则
,则 ( )
( ) |=2,|
|=2,| |=4,向量
|=4,向量 B.
B.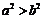 C.
C. D.
D.



 (一)工艺流程
(一)工艺流程
 (1)与O2反应:常温下,铝表面可形成致密的氧化膜保护层,故金属铝有一定的抗腐蚀性。点燃或加热时与O2反应的化学方程式为:4Al+3O2 2Al2O3。
(1)与O2反应:常温下,铝表面可形成致密的氧化膜保护层,故金属铝有一定的抗腐蚀性。点燃或加热时与O2反应的化学方程式为:4Al+3O2 2Al2O3。 (2)在点燃或加热的条件下与Cl2、S反应,化学反应方程式分别为:2Al+3Cl2 2AlCl3,2Al+3S
Al2S3。
(2)在点燃或加热的条件下与Cl2、S反应,化学反应方程式分别为:2Al+3Cl2 2AlCl3,2Al+3S
Al2S3。 与某些盐(如CuCl2)溶液反应的化学方程式为:2Al+3CuCl2=2AlCl3+3Cu。
与某些盐(如CuCl2)溶液反应的化学方程式为:2Al+3CuCl2=2AlCl3+3Cu。