网址:http://m.1010jiajiao.com/timu_id_4454903[举报]
已知:
(1)天然橡胶主要成分的结构为: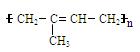
其单体的名称为_________________________________,该单体与溴发生加成反应时,可能生成的产物有_________种。
(2)天然橡胶的单体经臭氧氧化并在锌粉存在时水解生成的物质中除HCHO外,还有(写结构简式): ______________________________________,产物的物质的量之比依次为:__________________。
(3)写出由环己醇(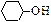 )合成己二醛(
)合成己二醛(  )各步反应的化学方程式:
)各步反应的化学方程式:
________________________________、____________________________________。
(4)已知某烃A,俗名为柠檬烯,化学式为C10H16,A经臭氧分解后得到1mol HCHO和1mol 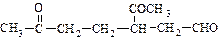 。A经催化加氢后得到的产物B,其化学式为C10H20,分子内含有六元环。请推导A的结构简式。
。A经催化加氢后得到的产物B,其化学式为C10H20,分子内含有六元环。请推导A的结构简式。
A___________________________________。
已知:
(1)天然橡胶主要成分的结构为:
其单体的名称为_________________________________,该单体与溴发生加成反应时,可能生成的产物有_________种。
(2)天然橡胶的单体经臭氧氧化并在锌粉存在时水解生成的物质中除HCHO外,还有(写结构简式): ______________________________________,产物的物质的量之比依次为:__________________。
(3)写出由环己醇()合成己二醛(
)各步反应的化学方程式:
________________________________、____________________________________。
(4)已知某烃A,俗名为柠檬烯,化学式为C10H16,A经臭氧分解后得到1mol HCHO和1mol 。A经催化加氢后得到的产物B,其化学式为C10H20,分子内含有六元环。请推导A的结构简式。
A___________________________________。
查看习题详情和答案>>
已知:
(1)天然橡胶主要成分的结构为:

其单体的名称为_________________________________,该单体与溴发生加成反应时,可能生成的产物有_________种。
(2)天然橡胶的单体经臭氧氧化并在锌粉存在时水解生成的物质中除HCHO外,还有(写结构简式): ______________________________________,产物的物质的量之比依次为:__________________。
(3)写出由环己醇(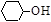 )合成己二醛(
)合成己二醛(  )各步反应的化学方程式:
)各步反应的化学方程式:
________________________________、____________________________________。
(4)已知某烃A,俗名为柠檬烯,化学式为C10H16,A经臭氧分解后得到1mol HCHO和1mol 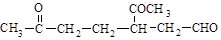 。A经催化加氢后得到的产物B,其化学式为C10H20,分子内含有六元环。请推导A的结构简式。
。A经催化加氢后得到的产物B,其化学式为C10H20,分子内含有六元环。请推导A的结构简式。
A___________________________________。
查看习题详情和答案>>
已知:
(1)天然橡胶主要成分的结构为:

其单体的名称为_________________________________,该单体与溴发生加成反应时,可能生成的产物有_________种。
(2)天然橡胶的单体经臭氧氧化并在锌粉存在时水解生成的物质中除HCHO外,还有(写结构简式): ______________________________________,产物的物质的量之比依次为:__________________。
(3)写出由环己醇(![]() )合成己二醛(
)合成己二醛( ![]() )各步反应的化学方程式:
)各步反应的化学方程式:
________________________________、____________________________________。
(4)已知某烃A,俗名为柠檬烯,化学式为C10H16,A经臭氧分解后得到1mol HCHO和1mol ![]() 。A经催化加氢后得到的产物B,其化学式为C10H20,分子内含有六元环。请推导A的结构简式。
。A经催化加氢后得到的产物B,其化学式为C10H20,分子内含有六元环。请推导A的结构简式。
A___________________________________。
查看习题详情和答案>>已知:![]()
(1)天然橡胶主要成分的结构为:![]()
其单体的名称为________,该单体与溴发生加成反应时,可能生成的产物有________种.
(2)天然橡胶的单体经臭氧氧化并在锌粉存在时水解生成的物质中除HCHO外,还有(写结构简式):________,产物的物质的量之比依次为:________.
(3)写出由环己醇( )合成己二醛(
)合成己二醛(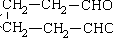 )各步反应的化学方程式:________、________.
)各步反应的化学方程式:________、________.
(4)已知某烃A,俗名为柠檬烯,化学式为C10H16,A经臭氧分解后得到1 mol HCHO和1 mol  .A经催化加氢后得到的产物B,其化学式为C10H20,分子内含有六元环.请推导A的结构简式.
.A经催化加氢后得到的产物B,其化学式为C10H20,分子内含有六元环.请推导A的结构简式.
A________.