摘要:(5)与D同主族的短周期元素E单质与氯气反应的物质的量之比为1:8.则它的总化学反应式是 .
网址:http://m.1010jiajiao.com/timu_id_66686[举报]
一、选择题
6.D 7.A 8.D 9.D 10.A 11.B 12.D 13.B
(化学部分).files/image148.jpg) 26.(16分)(1)
26.(16分)(1)(化学部分).files/image150.gif) (2)
(2)(化学部分).files/image152.gif) 极性、非极性、直线型
极性、非极性、直线型
(化学部分).files/image148.jpg) (3)
(3)(化学部分).files/image154.gif) (4)
(4)(化学部分).files/image156.gif) ,(5)
,(5)(化学部分).files/image158.gif)
(化学部分).files/image148.jpg) 27.(18分)
(1)①
27.(18分)
(1)①(化学部分).files/image160.gif)
(化学部分).files/image148.jpg) ②碱石灰(或
②碱石灰(或(化学部分).files/image162.gif) 或生石灰)
或生石灰)
(化学部分).files/image148.jpg) ③极易溶于水,水溶液呈碱性 ④B
③极易溶于水,水溶液呈碱性 ④B
(化学部分).files/image148.jpg) (2)让空气通过灼热的铜网 ①混合
(2)让空气通过灼热的铜网 ①混合(化学部分).files/image164.gif) 并使其干燥 ②观察导气管口气泡数量,调查气体流量,使
并使其干燥 ②观察导气管口气泡数量,调查气体流量,使(化学部分).files/image166.gif) 达最佳混合比1:3 将湿润的红色石蕊试纸靠近出气管口,试纸变量,说明气体为
达最佳混合比1:3 将湿润的红色石蕊试纸靠近出气管口,试纸变量,说明气体为(化学部分).files/image115.gif) (其他合理答案同样给分)
(其他合理答案同样给分)
(3)89.6L
28.(12分) (1)(化学部分).files/image169.gif)
(化学部分).files/image170.jpg)
(2)加成反应 强见的醇溶液、加热(化学部分).files/image171.jpg)
(化学部分).files/image173.jpg)
 短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.
短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.(1)E在元素周期表中的位置是
第三周期第ⅥA族
第三周期第ⅥA族
(2)由A、C、F三种元素按原子个数比、1:1:1组成的化合物与BA3反应生成B的单质,写出该反应的化学方程式
3HClO+2NH3=3HCl+N2+3H2O
3HClO+2NH3=3HCl+N2+3H2O
.(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的
| c(H+)甲 | c(H+)乙 |
10-4
10-4
;乙溶液中所含离子的物质的量浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.(4)用如图所示装置电解由D与F形成盐的饱和溶液时,若阴、阳极都用铁作电极,则阳极的电极反应式为
Fe-2e-=Fe2+
Fe-2e-=Fe2+
,溶液中出现的现象是产生气泡,有白色沉淀生成
产生气泡,有白色沉淀生成
. 短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.请回答下列问题:
(1)C的最高价氧化物对应水化物电子式为


离子键、极性键
离子键、极性键
.(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分.将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为
2I-+ClO-+H2O=I2+Cl-+2OH-
2I-+ClO-+H2O=I2+Cl-+2OH-
(3)用石墨电极电解CD的饱和溶液,若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体的物质的量为
0.01
0.01
mol.(4)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是(填序号)
①③
①③
.①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
(5)25℃时,将pH=4.00的A元素与D元素形成化合物AD的水溶液稀释1.00×103倍,则稀释后溶液中各离子浓度必遵循的定量等式关系式是
c(OH-)+c(Cl-)=c(H+)
c(OH-)+c(Cl-)=c(H+)
.(6)将一定量的D单质通入一定浓度的苛性钾溶液,两者恰好完全反应(已知反应过程放热),生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.该苛性钾溶液中KOH的质量是
16.8
16.8
.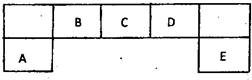 短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题
短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题(1)描述D在元素周期表中的位置:
第二周期第ⅥA族
第二周期第ⅥA族
(2)比较A、C、D元素简单离子半径的大小:
N3-
N3-
>O2-
O2-
>Al3+
Al3+
(填微粒符号)(3)F与D同主族且相邻,请说出D的氢化物比F的氢化物稳定的根本原因:
N的非金属性比S强
N的非金属性比S强
(4)C的氢化物与其最高价氧化物对应的水化物反应,产物溶于水呈
酸
酸
性,用离子方程式解释原因NH4++H2O?NH3.H2O+H+
NH4++H2O?NH3.H2O+H+
.(5)D原子与氢原子可形成10电子阳离子,写出该阳离子的电子式


(6)E的最高价氧化物的水化物的化学式为
HClO4
HClO4
.E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,该反应的化学反应方程式为8HCl+KClO4
KCl+4Cl2↑+4H2O
| ||
8HCl+KClO4
KCl+4Cl2↑+4H2O
.
| ||
短周期元素a、b、c、d、e、f、g、h的原子序数依次增大.其中a是原子半径最小的原子,a和e、c和g、d和h同主族.b元素的最高正价和最低负价的绝对值之差为2; e单质能与冷水剧烈反应生成H2;f原子最外层电子数等于其周期序数;h-的电子层结构与Ar原子相同.
(1)f原子结构示意图为 ;d和e形成的化合物电子式为 ;
(2)c和f简单离子的半径大小为 ;(用离子符号和“>”“=”或“<”表示)
(3)c与g的气态氢化物沸点较高的是 (填氢化物 分子式),原因是 .
(4)元素非金属性强弱的比较有很多方法,其中g和h的非金属性强弱的研究方案中不可行的是 (填序号);
①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较两种单质常温下的状态 ④比较最高价氧化物对应水化物的酸性
⑤由g和h的相互制备情况进行判断
(5)写出e、f的最高价氧化物对应水化物间反应的离子方程式 .
查看习题详情和答案>>
(1)f原子结构示意图为
(2)c和f简单离子的半径大小为
(3)c与g的气态氢化物沸点较高的是
(4)元素非金属性强弱的比较有很多方法,其中g和h的非金属性强弱的研究方案中不可行的是
①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较两种单质常温下的状态 ④比较最高价氧化物对应水化物的酸性
⑤由g和h的相互制备情况进行判断
(5)写出e、f的最高价氧化物对应水化物间反应的离子方程式
短周期元素A、B、C、D、E的原子序数依次增大,A的一种同位素的质量数为1,A和B同主族,C原子的最外层电子数是电子层数的3倍,D的最高正价与最低负价的绝对值相等,E的最高价氧化物的水化物的化学式为HnEO2n+2.下列说法正确的是( )
| A、A-离子半径小于B+离子半径 | B、B单质在C单质中燃烧生成原子个数比为1:1的化合物 | C、D的氧化物为酸性氧化物,溶于水可制得D的含氧酸 | D、D与E组成的化合物中,各原子最外层均达到8电子结构 |