2、二氧化碳
⑴、CO2 的化学性质
① CO2不能燃烧,不支持燃烧,也不能供给呼吸。(但CO2是无毒的)
② CO2跟水反应生成碳酸 CO2+ H2O ===H2CO3
碳酸能使紫色石蕊试液变红,碳酸不稳定,很易分解成水和二氧化碳。H2CO3 === CO2 + H2O
③ CO2能使澄清石灰水变浑浊 CO2 + Ca(OH)2 ==CaCO3 ↓+ H2O
⑵ 、二氧化碳的重要用途
①灭火②工业原料可制纯碱、尿素和汽水③干冰可作致冷剂、可用于人工降雨④温室肥料。
⑶、CO2的工业制法--高温煅烧石灰石或大理石: CaCO3 
 CaO + CO2 ↑
CaO + CO2 ↑
⑷、CO2 的实验室制法
①、药品:大理石或石灰石、稀盐酸
②、原理:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
③、仪器装置
④、实验步骤:查、装、定、加、收。
1、H2、CO、C还原CuO实验的比较
|
|
H2还原CuO |
CO还原CuO |
C还原CuO |
|
|
化学方程式 |
H2+CuO  Cu + H2O Cu + H2O |
CO+CuO  Cu +CO2 Cu +CO2 |
C +2 CuO  2Cu +CO2↑ 2Cu +CO2↑ |
|
|
装置图 |
 |
 |
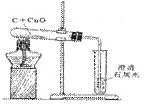 |
|
|
装置特点 |
①试管口略向___倾斜;②通H2 的导管伸至试管底部于CuO 上方 |
因CO有____,增加对尾气处理装置,防止CO污染空气 |
①试管口略向下倾斜;②反应需高温; |
|
|
操作步骤 |
反应前需检验气体纯度。还原过程分四步:一通,二点,三撤,四停 |
①检查气密性;②装药品固定试管;③点燃;④移导管,熄灭酒精灯。 |
||
|
实验现象 |
①黑色CuO 变成___色;②试管口有___生成 |
①黑色CuO 变成___色;②生成的气体使澄清石灰水变浑浊 |
①黑色固体逐渐减少;②有光亮红色固体生成;③生成的气体使澄清石灰水变浑浊 |
|
O2、H2、CO2的实验室制法比较
|
|
氧气(O2) |
氢气(H2) |
二氧化碳(CO2) |
|
反应原理 |
 2KClO3 2KCl
+ 3O2↑ 2KClO3 2KCl
+ 3O2↑2KMnO4  K2MnO4 +MnO2+O2↑ K2MnO4 +MnO2+O2↑ |
Zn +H2SO4== ZnSO4+H2↑ Zn + 2HCl =ZnCl2 + H2↑ |
CaCO3+2HCl== CaCl2+H2O+CO2↑ |
|
发生装置 |
 |
 |
 |
|
收置方法 |
①向上排空气法(密度比空气大); ②排水法(不易溶于水) |
①向下排空气法(密度比空气小); ②排水法(难溶于水) |
只能用向上排空气法(密度比空气大,能溶于水) |
|
操作步骤 |
①组装仪器②检查装置的气密性③装药品④固定装置⑤加热⑥收集气体⑦把导管撤出水槽⑧熄灭酒精灯。 |
①组装仪器②检查装置的气密性③加药品④验纯⑤收集气体 |
①组装仪器②检查装置的气密性③加入大理石④从漏斗注入稀盐酸⑤收集气体 |
|
验
满 |
向上排空气法收集时,用带火星的木条放在集气瓶口,木条复燃,说明收集已满。排水法收集时,气泡往集气瓶外冒时,收集已满。 |
用排水法收集时,当气泡往外冒时,说明收集已满。 |
用燃着的木条放在集气瓶口,若木条熄灭,说明收集已满。 |
|
检验或验纯 |
验证:用带火星木条伸入集气瓶内,木条复燃,说明是氧气 |
验纯:收集一试管氢气,用大拇指堵住,管口向下,移近酒精灯火焰,若发出微弱的“噗”的一声,说明氢气已纯,若发出尖锐的爆鸣声,说明氢气不纯,应再收集再检验。 |
验证:通入澄清石灰水,石灰水变浑浊,说明是二氧化碳。 [CO2 +Ca(OH)2 == CaCO3↓+H2O] |
|
注 意 事 项 |
试管口应略向下倾斜,以防水倒流至试管底部,使试管炸裂;排水法收集时当气泡连续均匀冒出时开始收集,以免收集气体不纯;排水法收集完后,先将导管移出水槽,再停止加热,以免水槽中的水倒流至热试管,使试管炸裂。 |
长颈漏斗下端应伸入液面以下,以免生成的气体从长颈漏斗中逸出;用排空气法收集时,导管应伸入集气瓶底部;验纯时,浓盐酸有挥发性,浓硫酸、硝酸具有强氧化性,
Cu 等金属不与稀酸反应,所以都不宜用来制氢气。 |
不能用稀H2SO4 代替稀盐酸,因为稀H2SO4 与CaCO3 反应生成微溶性的CaSO4 覆盖在CaCO3表面,从而阻止反应的进一步进行。 |
◆实验室制取气体的思路和方法:
①首先要研究实验室制法的反应原理,即在什么条件下,用什么药品通过什么反应,制取这种气体。②其次根据反应物的状态、反应条件和生成气体的性质来设计实验装置。
③最后还要研究如何验证制得的气体就是所需要的气体。
练习
1、碳的几种单质
⑴ 金刚石和石墨的物理性质用途对比:
|
|
金刚石 |
石墨 |
|
组成元素 |
碳 |
碳 |
|
外观 |
无色透明正八面体状晶体 |
深灰色、不透明细鳞片状固体 |
|
光泽 |
加工琢磨后有夺目光泽 |
有金属色泽 |
|
硬度 |
天然存在的最硬物质 |
最软的矿物质之一 |
|
熔点 |
高 |
高 |
|
润滑性 |
无 |
良好 |
|
导电、导热性 |
无 |
良好 |
|
用途 |
钻探机的钻头、玻璃刀、装饰品等 |
电极、铅笔芯、特别是高温工作中的机器的润滑剂 |
⑵ 碳的化学性质
碳在常温下性质稳定,在高温下,碳能跟许多物质起反应。(想一想:碳的化学性质与哪种物质相似?)
① 可燃性: (都放热-可作燃料)
C + O2  CO2(充分燃烧) 2C + O2
CO2(充分燃烧) 2C + O2  2CO(不充分燃烧)
2CO(不充分燃烧)
② 还原性:(--冶炼金属)
2CuO + C  2Cu + CO2 ↑
C + CO2
2Cu + CO2 ↑
C + CO2  2CO(吸热反应)
2CO(吸热反应)
现象:黑色氧化铜变成红色,澄清石灰水变浑浊。 现象:黑色粉末不断减小
碳的氧化物


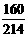 m1时,则“红色铁泥”中一定含有氧化铁吗?
(填写“一定”或“不一定”),理由是
。
m1时,则“红色铁泥”中一定含有氧化铁吗?
(填写“一定”或“不一定”),理由是
。 氯化铵和熟石灰 生石灰
氯化铵和熟石灰 生石灰