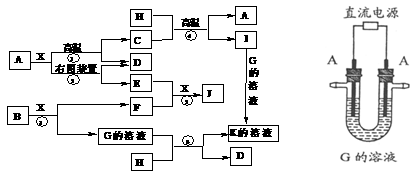
1.[南京市2009届高三第一次调研测试]下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
|
Z |
|
|
|
|
|||||||||||||
|
|
|
M |
L |
Q |
R |
|
|
||||||||||
|
D |
A |
|
|
T |
X |
Y |
|
||||||||||
|
E |
|
|
|
|
|
|
|
|
J |
|
|
|
|
|
|
|
|
(1)Y分别与D、E形成的化合物中熔点较高是 ▲ (用化学式表示);T、X、Y原子的第一电离能由小到大的顺序是 ▲ (用元素符号表示)。
(2)LX2分子的电子式是 ▲ ,XY2分子是 ▲ (填“极性分子”或“非极性分子”);QY3分子中Q采用 ▲ 杂化。
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。则J原子的核外电子排布式是 ▲ (基态);与配体粒子互为等电子体的离子是 ▲ ;J(LR)4固态时属于 ▲ 晶体(填晶体类型)
(4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有多同分异构体(其中Q以三个单键与其它原子相连),写出其中沸点最低的物质结构简式 ▲ 。
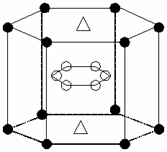
(5)A与M组成的一种化AM2,刷新了金属化合物超导 温度的最高记录。右图中所示的是该化合物的晶体结构单元。图中上下底面中心“Δ”处的原子是 ▲ (填元素符号)。

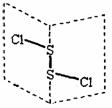 2.[盐城市伍佑中学2009年江苏高考化学押题卷]二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是[B]
2.[盐城市伍佑中学2009年江苏高考化学押题卷]二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是[B]
A.S2Cl2的电子式为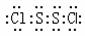
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:
2S2Cl2+2H2O=SO2↑+3S↓+4HCl
15.(10分) 有一包白色固体混合物,可能含有的阴、阳离子分别是:
|
阳离子 |
K+ Na+ Ag+ NH4+ Mg2+ Ba2+ |
|
阴离子 |
SO42 – SO32- CO32- AlO2- MnO4- |
为了鉴定其中的离子,现进行以下实验:
(1)取该粉末,加水后得到无色透明溶液,且未嗅到气味;用pH试纸测得溶液的pH为12。
则排除的离子是 。
(2)向溶液中滴加盐酸,开始有沉淀生成,继续滴加沉淀消失,同时有无色无味气体逸出。
则肯定存在的离子是 ,排除的离子是 。
(3)尚待检验的离子是 ,检验方法是 。

 2Fe2+ + Cu2+)。请按要求完成下列探究报告。
2Fe2+ + Cu2+)。请按要求完成下列探究报告。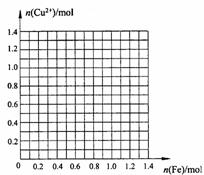 [拓展延伸]
[拓展延伸] (1)如何检验该装置的气密性____________________。
(1)如何检验该装置的气密性____________________。