8. (17分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·2Cr2O3)利用以下过程来制取。
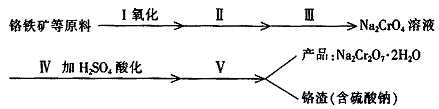
①步骤Ⅰ中反应的化学方程式为:
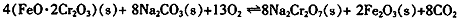
在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
A. 升高温度 B. 通入过量的氧气
C. 将原料粉碎 D. 增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
③步骤Ⅲ是除去Na2CrO4溶液中的杂质。
④步骤Ⅳ中发生反应的离子方程式为: 。
(2)将红矾钠与KCl固体按物质的量比为1:2混合溶于水后经适当操作可得到K2Cr2O7晶体。其溶解度随温度升高而升高且受温度影响大,请填写表中空格,探究制备过程。
|
序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
|
① |
溶解 |
将混合物放入烧杯中,加水,充分搅拌直到固体不再溶解。 |
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
⑤ |
过滤、干燥 |
得到K2Cr2O7晶体 |
(3)K2Cr2O7的酸性溶液具有很强的氧化性,试写出其与FeSO4溶液反应的离子方程式:
。
7. (11分)以下是25℃时几种难溶电解质的溶解度:
|
难溶电解质 |
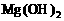 |
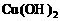 |
 |
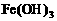 |
|
溶解度/g |
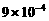 |
 |
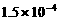 |
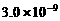 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质。例如:
①为了除去氯化铵中的杂质FeCl3,先将混合物溶于水,再加入一定量的试剂充分反应后,过滤结晶即可;
②为了除去氯化镁晶体中的杂质FeCl3,先将混合物溶于水,加入足量的氢氧化镁,充分反应后,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质FeSO4,先将混合物溶于水,加入一定量的酸性H2O2溶液,将Fe2+氧化成Fe3+后,调升溶液的pH=4后,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 (填化学式)而除去。
(2)①中加入的试剂应该选择 为宜,其原因是 。
(3)②中除去FeCl3所发生反应的离子方程式为 。
(4)下列与方案③相关的叙述中,正确的是 (填字母序号)。
A. H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B. 将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C. 调升溶液pH=4可选择的试剂是氢氧化铜
D. Cu2+不能大量存在于pH=4的溶液中
E. 在pH>4的溶液中Fe3+一定不能大量存在


 C(g)+3D(g)△H<0。现将2mol A和2mol B充入体积为V的甲容器,将2mol
C和6mol D充入体积为2V的乙容器。关于两容器中反应的说法正确的是( )。
C(g)+3D(g)△H<0。现将2mol A和2mol B充入体积为V的甲容器,将2mol
C和6mol D充入体积为2V的乙容器。关于两容器中反应的说法正确的是( )。
 ,阴极反应式为:
,阴极反应式为: ,电解完全后,溶液中的酸性增强
,电解完全后,溶液中的酸性增强
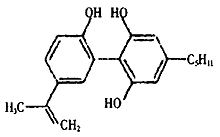
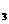 的稀溶液中,微热使其充分反应,
的稀溶液中,微热使其充分反应,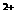 、Cu
、Cu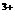 与Fe
与Fe