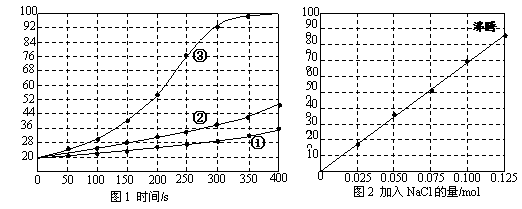
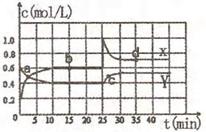
21.(12分)煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)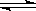 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数Kc |
9.94 |
9 |
1 |
试回答下列问题
(1)上述正向反应是: 反应(选填:放热、吸热)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E)。
|
|
A |
B |
C |
D |
E |
|
n(CO2) |
3 |
1 |
0 |
1 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
2 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
3 |
|
n(H2O) |
5 |
2 |
3 |
2 |
1 |
(3)已知在一定温度下:C(s)+CO2(g) 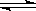 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) 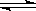 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g)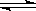 H2(g)+CO2(g) 平衡常数K2
,
H2(g)+CO2(g) 平衡常数K2
,
则K、K1、K2之间的关系是: 。
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol/L,在该条件下,CO的最大转化率为: 。
(5)若在800℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y= 。
(6)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K= 。
 CH3OH(g)
CH3OH(g)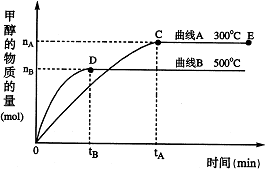
 3C(g)
+ D(s),2分钟反应达到平衡,此时C的浓度为1.2
mol/L。
3C(g)
+ D(s),2分钟反应达到平衡,此时C的浓度为1.2
mol/L。 2SO3(g) △H<0,回答下列问题:
2SO3(g) △H<0,回答下列问题:

 15.已知NO2和N2O4可以相互转化:
15.已知NO2和N2O4可以相互转化: △H
< 0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如右图。下列说法正确的是 ( )
△H
< 0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如右图。下列说法正确的是 ( )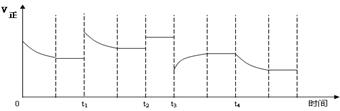 合成氨反应:N2(g)
+ 3H2(g)
合成氨反应:N2(g)
+ 3H2(g)  2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:  2Z(g),若X、Y、Z的起始浓度分别为c
2Z(g),若X、Y、Z的起始浓度分别为c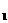 、c
、c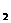 、c
、c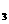 (均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( ) C(g)+D(g),5min后达到平衡,各物质的平衡浓度有如下关系: c a (A)×c(B)=c(C) ×c(D)。若在此温度下,将容器的体积扩大为原来的10倍,B的转化率不变,则此时A的转化率 ( )
C(g)+D(g),5min后达到平衡,各物质的平衡浓度有如下关系: c a (A)×c(B)=c(C) ×c(D)。若在此温度下,将容器的体积扩大为原来的10倍,B的转化率不变,则此时A的转化率 ( )