3.碳酸钠和碳酸氢钠的性质和制法:
|
名称和化学式 |
碳酸钠(Na2CO3) |
碳酸氢钠(NaHCO3) |
|
俗名 |
纯碱、苏打 |
小苏打 |
|
颜色和状态 |
白色晶体 |
白色粉末 |
|
水中溶解性 |
易溶 |
易溶(比Na2CO3小) |
|
热稳定性 |
稳定 |
不稳定 2NaHCO3 Na2CO3+CO2  +H2O +H2O |
|
与酸反应 |
CO2-3+H+ HCO-3 HCO-3HCO-3+H+  H2O+CO2 H2O+CO2 |
HCO-3+H+ CO2 CO2 +H2O +H2O |
|
与某些碱反应 |
Ca(OH)2+Na2CO3 CaCO3 CaCO3 +2 +2NaOH |
NaHCO3+Ca(OH)2 CaCO3 CaCO3 +NaOH+H2O 2NaHCO3+Ca(OH)2  CaCO3 CaCO3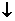 +Na2CO3+2H2O +Na2CO3+2H2O |
|
与某些盐反应 |
BaCl2+Na2CO3 BaCO3 BaCO3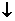 +2NaCl +2NaCl |
NaHCO3+NaHSO4 Na2SO4+ Na2SO4+H2O+CO2  |
|
与CO2反应 |
Na2CO3+CO2+H2O 2NaHCO3 2NaHCO3 |
不反应 |
|
相互转化 |
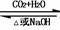 Na2CO3 NaHCO3 Na2CO3 NaHCO3
|
|
|
制法 |
NaOH+CO2 NaHCO3 NaHCO32NaHCO3  2Na2CO3+H2O+CO2 2Na2CO3+H2O+CO2 |
NaOH+CO2 NaHCO3 NaHCO3 |
|
鉴别 |
加酸产生CO2加热难分解 |
加酸产生CO2较Na2CO3快加热分解出CO2 |
|
用途 |
制玻璃、肥皂、造纸、纺织 |
发酵粉、治胃酸过多 |
2.钠的氧化物和氢氧化物的性质和制法:
|
名称和化学式 |
氧化钠(Na2O) |
过氧化钠(Na2O2) |
氢氧化钠(NaOH) |
|
颜色和状态 |
白色固体 |
淡黄色固体 |
无色固体 |
|
类别 |
碱性氧化物 离子化合物 |
过氧化物 离子化合物 |
碱 离子化合物 |
|
电子式 |
Na+[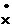  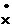 ]Na+ ]Na+ |
Na+[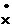  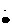  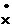 ]2-Na+ ]2-Na+ |
Na+[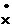  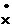 H]- H]- |
|
氧元素化合价 |
-2 |
-1 |
-2 |
|
化学键 |
离子键 |
离子键 非极性键 |
离子键 极性键 |
|
稳定性 |
不稳定 |
比Na2O稳定 |
离子键 极性键 |
|
与水反应 |
Na2O+H2O 2NaOH 2NaOH |
2Na2O2+2H2O 4NaOH+ 4NaOH+O2  |
不反应 |
|
与酸反应 |
Na2O+2HCl 2NaCl 2NaCl+H2O |
2NaO2+4HCl 4NaCl 4NaCl+O2  +2H2O +2H2O |
NaOH+HCl NaCl NaCl+H2O |
|
与酸酐反应 |
Na2O+CO2 Na2CO3 Na2CO3 |
2Na2O2+2CO2 2Na2 2Na2CO3+O2  |
2NaOH+CO2 Na2CO3 Na2CO3+H2O NaOH+CO2  NaHCO3 NaHCO3 |
|
与盐溶液反应 |
Na2O+2NaHSO4 2N 2NaSO4+H2O Na2O+H2O+CuSO4  Cu(OH)2  +Na2SO4 +Na2SO4 |
2Na2O2+4NaHSO4 4 4Na2SO4+O2  +2H2O +2H2O2Na2O2+H2O+CuSO4  Cu(OH)2  +2Na2SO4+O2 +2Na2SO4+O2 |
NaOH+NaHSO4 Na2 Na2SO4+H2O 2NaOH+CuSO4  Cu( Cu(OH)2 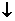 +Na2SO4 +Na2SO4 |
|
制法 |
2Na+Na2O2 2Na2O 2Na2O6Na+2NaNO2  N2 N2 +4Na2O +4Na2O |
2Na+O2 Na2O2 Na2O2 |
Na2O+H2O 2NaOH 2NaOH2NaCl+2H2O  2NaOH+ 2NaOH+Cl2  +H2 +H2 |
|
用途 |
制氢氧化钠 |
漂白剂、供氧剂、氧化剂 |
化工原料、制纸浆、肥皂 |
1.碱金属元素原子结构、单质性质、制法:
|
名称和符号 |
锂(Li) |
钠(Na) |
钾(K) |
铷(Rb) |
铯Cs |
||
|
结 构 |
原子序数 |
3 |
11 |
19 |
37 |
55 |
|
|
原子结构简图 |
 |
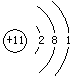 |
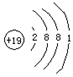 |
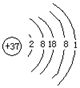 |
 |
||
|
电子式 |
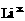 |
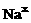 |
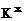 |
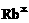 |
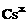 |
||
|
主要化合价 |
+1 |
+1 |
+1 |
+1 |
+1 |
||
|
相同点 |
最外层电子数相同,都是1个电子 |
||||||
|
不同点 |
原子核外电子层不同,依次增多 |
||||||
|
原子半径 |
依次递增 |
||||||
|
离子半径 |
依次递增 |
||||||
|
金属活动性 |
依次递增 |
||||||
|
单质还原性 |
依次递增 |
||||||
|
阳离子氧化性 |
依次递减 |
||||||
|
物理性质 |
颜色和状态 |
银白色固体 |
|||||
|
密度 |
0.534/cm3 |
1.97/cm3 |
0.86g/cm3 |
1.532g/cm3 |
1.879g/cm3 |
||
|
熔点 |
依次递减 |
||||||
|
沸点 |
依次递减 |
||||||
|
化学性 质 |
跟氧气反应 |
2Li+O2 2LiO |
4Na+O2 2Na2O 2Na+O2  Na2O2 |
2K+O2 K2O2 K+O2  KO2 |
Rb+O2 RbO2 |
Cs+O2 CsO2 |
|
|
跟卤素反应 |
2M+X2 2MX(M、X2表示碱金属、卤素) 2MX(M、X2表示碱金属、卤素) |
||||||
|
跟硫反应 |
2M+S M2S M2S |
||||||
|
与水反应 |
2M+2H2O 2MOH+H2 2MOH+H2 反应剧烈程度:Li<Na<K<Rb<Cs 反应剧烈程度:Li<Na<K<Rb<Cs |
||||||
|
与酸反应 |
2M+2H+ 2M++H2 2M++H2 |
||||||
|
与盐溶液反应如(CuSO4) |
2M+2H2O+CuSO4 M2SO4+Cu(OH)2 M2SO4+Cu(OH)2 +H2 +H2 |
||||||
|
制法 |
 2MCl 2MCl 2M+Cl2 2M+Cl2 (K:Na+KCl 850℃ K+NaCl ) (K:Na+KCl 850℃ K+NaCl ) |
||||||
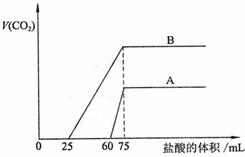 (15分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
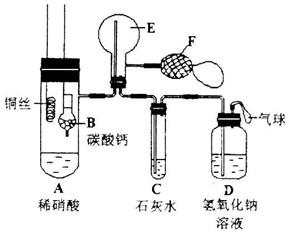
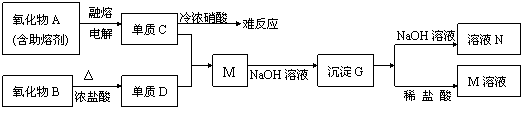
(15分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题: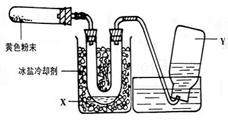 (20分)(Ⅰ)(10分)为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)。
(20分)(Ⅰ)(10分)为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)。