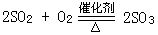17、常温下,将20.0g14%的NaCl溶液和30.0g24%的NaCl溶液混合,得到
密度为1.15g/cm3的混合溶液。
(1)该混合溶液的质量分数是 ______。
(2)该溶液的物质的量浓度是 ______mol/L。
(3)在1000g水中溶解______molNaCl才能使其浓度与上述混合溶液的浓
度相等。
|
18、向强碱性的热溶液中加入足量硫粉,发生反应生成S2-和 |
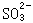 |
;生成物 |
|
继续跟硫粉作用生成 |
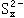 |
和 |
 |
。过滤后除去过量的硫,向滤液中加入一定 |
|
量的强碱后再通入足量的SO2,SO2跟 |
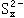 |
反应也完全转化为 |
 |
请回答: |
(1)写出以上各步反应的离子方程式
① ____________________________________,
② ____________________________________,
③ ____________________________________,
④ ____________________________________,
(2)若有amol硫经上述转化后,最终完全变为Na2S2O3,至少需SO2和NaOH
的物质的量分别是 ① ____________,② ____________。
(3)若原热碱液中含NaOH 6mol,则上述amol硫的转化过程里生成的 Na2Sx中
的X值为_______。
12、配平下列化学方程式或离子方程式,并回答有关问题。
① _____ Fe3P+_____ HNO3 ─ _____ Fe(NO3)3+_____ H3PO4 +
_____ NO+ _____ __________
② 上述反应中,若有21mol电子转移时,生成是H3PO4是______mol,被还
原的硝酸是 _____ g。
③ 上述反应中,当生成1.8mol Fe3+时,放出NO的体积(标准状况下)
是 ________ L,消耗的HNO3是 _______ mol。
(2)① ____ P +____ CuSO4+ ____ H2O ─ ____ Cu3P+___ H3PO4
+____ H2SO4
②上述反应中,1molCuSO4氧化P的物质的量为 _______ mol。
(3) _______ KIx + ____ CL2 + ____ H2O ─ ____ KCl + ____HIO3
+ _______ _________
若KIx与CL2的系数比为1:8,则x值为 ______ 。
|
(4) _____ Clm+_____ OH- ─ _____Cl-+______ |
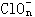 +______ +______ |
H2O
(5) _______ Na2Sx + ______ NaClO + _____ NaOH ─ _______
Na2SO4+ __________ NaCl+______ H2O
若 Na2Sx 在反应中消耗的NaClO和NaOH的物质的量之比为2:1,试比
求得的x值写出该多硫化钠的化学式 _______ 。
(6) ____ KClO4 + _____ CrCl2 + ____ H2SO4 + ____H2O ─ _____
H2Cr2O7+_____ Cl2↑+_____ K2SO4
① 氧化剂是 _______ ,还原剂是 _______ ,氧化产物是 ____________;
② 若反应过程中,有0.5molCl2被还原出来,则有 ____molCrCl2发生了
反应,并有 _____mol 电子发生了转移。
|
(7) _______ |
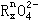 |
+_____________ |
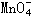 |
+_____________ H+ =__ |
_____RO2 + ______ Mn2++_________H2O
|
上述反应中,若0.2mol |
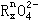 |
离子参加反应时共转移0.4mol电子。 |
① x值= ________ ;
② 参加反应的氢离子的物质的量为 _________ ;
③ 若RO2在常温下为气体,则R属于 _________ 族元素。
9、(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,请写出发生
反应的离子方程式:________________________________________。
(2)在以上中性溶液中,继续滴加 Ba(OH)2溶液, 请写出此反应的离
子方程式:___________________________。
|
10、在 |
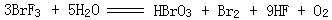 |
的反应中,每3mol的BrF3 |
中被水还原的BrF3的物质的量是 ________ 氧化产物与还原产物物质的量之比为_
__________。
|
11、在一定条件下, |
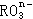 |
和 |
I- |
发生的离子方程式如下: |
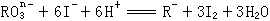
|
(1) |
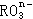 |
中R元素的化合价是 _________。 |
(2)R元素的原子最外层的电子数是 _________。