4.在标准状况下,将100毫升H2S和O2混合气体点燃反应后恢复到原状况,发现随 混和气体中O2所占的体积V氧气的变化,反应后所得气体的总体积V总也不同,其关系式如下图所示(气体体积均在同温同压下测定)。请回答下列问题:
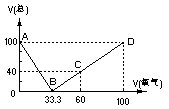
(1)写出图中B、C两点处的化学反应方程式
[答]:B点的反应:2H2S+O2 == 2S+2H2O C点的反应:2H2S+3O2 == 2SO2+2H2O
(2)通过对图像的分析得出:
①当V总>40毫升、②V总<40毫升、③V总=40毫升时气体的成分 [答]:
|
|
AB段 |
BD段 |
|
①V总>40毫升 |
H2S |
O2与SO2 |
|
②V总<40毫升 |
H2S或没有 |
SO2或没有 |
|
③V总=40毫升 |
H2S |
SO2 |
(3) 当V总=25毫升时,求原混合气体中H2S和O2的体积各多少毫升?
[答]:当V总=25毫升时,从图中可以看出,在AB段与BD段均有可能。
(1)当在AB段时,H2S过量,反应后剩余的气体就是过量的H2S。设原混和物中O2的体积为x毫升、H2S的体积为2x+y毫升(y毫升就是过量的H2S的体积),由题给条件可列出以下两式:
x+2x+y=100----------① 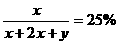 (或直接写出x=25)-----②
解得:x=y=25,所以原混和气体中H2S的体积为75毫升,O2的体积为25毫升。
(2)当在BD段时,两者的反应可直接写成以下的形式:
xH2S+yO2
==
(或直接写出x=25)-----②
解得:x=y=25,所以原混和气体中H2S的体积为75毫升,O2的体积为25毫升。
(2)当在BD段时,两者的反应可直接写成以下的形式:
xH2S+yO2
== S+
S+ SO2+xH2O
SO2+xH2O
其中x+y=100,所以 =0.25,解得:x=y=50毫升
所以原混和气体中两种气体的体积均为50毫升。
=0.25,解得:x=y=50毫升
所以原混和气体中两种气体的体积均为50毫升。

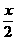 ];若当B转化为C时,反应后,常温下体系中只有C一种气体,x与y的数值关系是[答:
];若当B转化为C时,反应后,常温下体系中只有C一种气体,x与y的数值关系是[答: 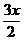 ]
] =0.02 摩
=0.02 摩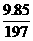 =0.05 摩
=0.05 摩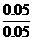 =1 摩/升
=1 摩/升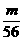 ×22.4升]
×22.4升]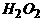
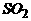
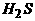 ]
]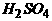 ]
]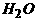 ]
]