25.(12分)测定硫酸铜晶体(CuSO4·xH2O)结晶水含量的实验流程如下:
回答下列问题:
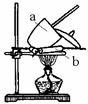 ⑴“操作I”是灼烧硫酸铜晶体,装置如右图。
⑴“操作I”是灼烧硫酸铜晶体,装置如右图。
指出装置中仪器名称:a_______________,b______________;
“操作I”之前应将块状的硫酸铜晶体放在______ _中研碎。
⑵“操作Ⅱ”的操作是________ _,必须在_____________ _中进行;
⑶ 判断硫酸铜晶体受热完全失去结晶水的依据是____ __(选填序号);
a.加热时无水蒸气 b.胆矾晶体由蓝变白
c.固体质量不再减小 d.固体质量不断减小
⑷ “重复操作Ⅰ、Ⅱ、Ⅲ”,称为恒重操作,判断达到恒重的依据是
___________________________________________________________ ____;
⑸做此实验时,最少应称量__________ __次。
⑹某学生实验后得到以下表数据:
|
加热前质量 |
加热后质量 |
|
|
m1(容器) |
m2(容器+晶体) |
m3(容器+无水硫酸铜) |
|
5.400 g |
7.900 g |
7.100 g |
①根据以上数据计算该硫酸铜晶体中结晶水x的值为_________________(精确到0.1)。
②该学生测定结果____________________(填“偏高”、“偏低”或“正确”)。
③从下列分析中选出该学生产生实验误差的原因可能是(填写字母)________________。
a.没有进行恒重操作 b.加热后在干燥器中冷却至室温后称量
c.加热过程中晶体有少量溅失 d.加热固体到白色后,露置在空气中冷却
古田一中2010-2011学年第二学期半期考试
高二化学《物质结构与性质》模块考试答案卷
24.(13分)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaC1、MgC12等。请回答
(1)“氯盐类”融雪剂主要成分的晶体类型为 。
(2)冰比硫化氢溶点高的原因是 ,
其分子中氧原子的杂化轨道类型为 。
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
X |
578 |
1817 |
2745 |
11578 |
|
Y |
738 |
1451 |
7733 |
10540 |
|
Z |
496 |
4562 |
6912 |
9543 |
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的原因是 。
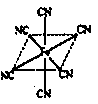 (4)融雪时刻对环境危害很大,如和路基上的铁等金属形成原电池,会加快路面面破损。铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如右图。
(4)融雪时刻对环境危害很大,如和路基上的铁等金属形成原电池,会加快路面面破损。铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如右图。
①铁元素基态原子价电子排布式为 。
②已知CN-与N2结构相似,1mol CN-中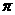 键数目为
。
键数目为
。
③上述沉淀溶解过程的化学方程式为 。
22.(12分)四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
室温下单质呈粉末状固体,加热易熔化。 单质在空气中燃烧,发出明亮的蓝紫色火焰。 |
单质常温、常压下是气体,能溶于水。 原子的M层有1个未成对的p电子。 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
原子最外层电子层上s电子数等于p电子数。单质为空间网状晶体,具有很高的熔、沸点。 |
⑴B元素在周期表中的位置 ,写出A原子的价电子轨道表示式 。
⑵写出C单质与水反应的化学方程式 。
⑶D元素最高价氧化物晶体的硬度 (填“大 ”或“小”),其理由是 。
⑷A、B两元素非金属性较强的是(写元素符号) 。写出证明这一结论的一个实验事实 。
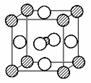
 球在晶体的体心,镍原子用大
球在晶体的体心,镍原子用大 球,
球, 球
球